控制变量是科学探究的重要方法之一。小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多。是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 溶解度(g) |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
168 |
①影响因素: 实验中,控制不变的因素是 。
②实验方案:
《蜡烛的化学史》是英国科学家法拉第所著的传世科普经典,今天我们沿着大师的足迹进行探究.蜡烛是由石蜡和棉线组成的.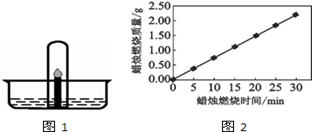
(1)石蜡放入水中,浮在水面上,说明石蜡的密度比水的密度(填“大”或“小”).
(2)点燃蜡烛在其燃烧过程中,属于物理变化的是.
(3)取一火柴梗,拿住一端迅速平放入火焰中约1秒后取出,可观察到两端变黑,中间无明显变化.说明火焰的(填“外焰”“内焰”或“焰心”)部分温度最高.
(4)轻轻一吹即可使蜡烛熄灭,原因是(填序号).
A.降低石蜡的着火点
B.隔绝了空气
C.温度降到了着火点以下.
(5)点燃一根直径为4cm的蜡烛,观察到烛芯周围有一杯状的烛油.蜡烛燃烧的质量与燃烧的时间呈现如图2所示的关系.
①据图判断蜡烛燃烧的化学反应速率是(选填“稳定”或“不稳定”)
②烛芯周围的烛油没能发生燃烧的原因是.
③事实上,人的呼吸与蜡烛的燃烧在某些化学原理论,人的呼吸与蜡烛的燃烧在某些化学原理上相似,请写出其中的一点.
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有①。
【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| 1)取少量样品溶于水,加入② |
白色沉淀产生 |
该反应的化学方程式:③ 氢氧化钠已经变质 |
| 2)将上述反应后的混合物过滤,取滤液加入④ |
⑤ |
证明猜想Ⅲ正确 |
回答下列问题
(1)实验室中,氢氧化钠固体应怎样保存?⑥
(2)用酚酞试液⑦(填“能”或“不能”)检验氢氧化钠变质。
(3)若取少量的固体溶于水, 滴加几滴稀盐酸,没有气泡产生。__⑧___(填“能”或“不能”)证明氢氧化钠固体没有变质。
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下: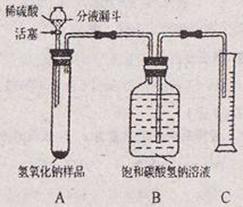
①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL。
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由⑨
(2)试管中原有的空气对实验结果没有明显影响理由是⑩
(3)变质氢氧化钠样品中碳酸钠的质量分数为⑪(20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液。请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、⑫、。
某化学兴趣小组用下图装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。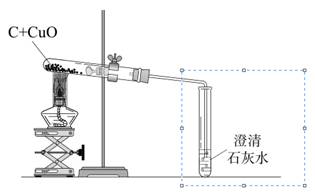
【提出问题】木炭与氧化铜反应生成的红色固体中含有什么物质?
【查阅资料】木炭与氧化铜反应也可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与稀硫酸反应:Cu2O+H2SO4 Cu+CuSO4+H2O。
Cu+CuSO4+H2O。
【进行猜想】木炭与氧化铜反应生成的红色固体成分:
①全部是铜; ②全部是; ③是两者的混合物。
【实验探究】
(1)用上图装置完成木炭还原氧化铜的实验,观察到澄清石灰水。
(2)试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体成分进行探究:
| 步 骤 |
现 象 |
结 论 |
| ①取1.8g红色固体于试管中, 滴加足量,充分反应 |
猜想①错误 |
|
| ②过滤,将滤渣洗涤、干燥、称量 |
所得固体质量 |
猜想③正确 |
【反思与评价】木炭还原氧化铜的实验中,生成的气体可能含有一氧化碳,为了防止对空气造成污染,可将上图虚线方框内的装置改为(选填字母)。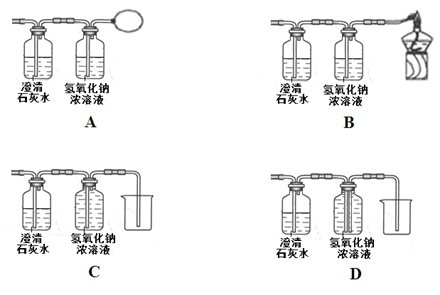
某学习小组围绕“气体实验室制取”进行了研讨。请你参与完成下面的问题。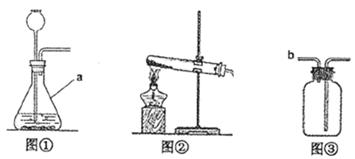
(1)原理分析:实验室制取CO2的化学方程式为。
不用Na2CO3与盐酸反应制取CO2的原因是。
(2)发生装置:图①装置中仪器a的名称是。实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图(填序号)发生装置。
(3)收集装置:实验室收集NH3(极易溶于水)应采用的方法是。收集有毒气体SO2时,常采用③收集装置,气体应从(填字母)端通入。
在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题: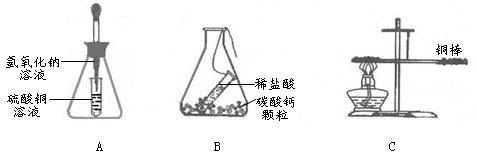
(1)如图A、B所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
①A瓶重新放回到天平上,天平(填“能”或“不能”)保持平衡。
②B瓶重新放回到天平上,天平能否保持平衡?,理由是。
③从原子的角度分析“质量守恒定律” 。
(2)如上图C所示,用细线系住铜棒使之平衡,然后在铜棒一端用酒精灯加热。铜在加热的条件下,能与空气中的氧气反应生成氧化铜。
①写出铜在空气中加热的化学方程式。
②加热一段时间后,铜棒(填“能”或“不能”)保持平衡。