氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用。
(1)请写出工业上由NH3制取NO的化学方程式 。
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+ CO2(g) FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。
FeO(s)+ CO(g),已知该反应的平衡常数K与温度T的关系如图所示。
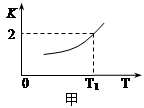
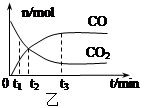
①该反应的逆反应是 (填“吸热”或“放热”)反应。
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 。
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)= v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO和CO2物质的量与时间的关系如图乙所示。则CO2的平衡转化率为 ,平衡时混合气体的密度与起始时气体的密度之比为 。
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特定见下表。
2NH3,有关数据及平衡状态特定见下表。
| 容器 |
起始投入 |
达平衡时 |
|||
| 甲 |
2 mol N2 |
3 mol H2 |
0mol NH3 |
1.5mol NH3 |
同种物质的体积分数相同 |
| 乙 |
a mol N2 |
b mol H2 |
0mol NH3 |
1.2mol NH3 |
起始时乙容器中的压强是甲容器的 倍。
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量。生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 倍。请写出该反应的热化学方程式 。
倍。请写出该反应的热化学方程式 。
H2O2是重要的化工原料。
(1)H2O2中O元素的化合价为______。
(2)①向酸性KMnO4溶液中滴加H2O2溶液,溶液褪色,体现了H2O2的还原性,其中氧化过程是:H2O2→______(填化学式)。
②向H2SO4酸化的FeSO4溶液中滴加H2O2溶液,溶液变成黄色,体现了H2O2的氧化性,反应的离子方程式是_________。
(3)H2O2不稳定易分解。实验室需要448 mL O2(标准状况),则理论上最少需要用30%的H2O2溶液(密度为1.10 g/mL)_______mL。(计算结果保留一位小数)
实验室常用不含Fe3+的FeSO4溶液与NaOH溶液反应制备Fe(OH)2。
(1)用FeSO4晶体配制上述FeSO4溶液时还需加入来防止Fe2+被氧化,配制时所需的蒸馏水常采用的方法除去溶解的O2,检验所配FeSO4溶液中不含有Fe3+的最佳试剂是。
(2)Fe(OH)2露置在空气中容易被氧化,试写出该反应的化学方程式并用单线桥法表示该反应的电子转移情况;为防止Fe(OH)2氧化,实验时可在FeSO4溶液中加入适量的(选填“煤油”或“四氯化碳”)来隔绝空气。
按要求回答下列问题:
(1)O4是意大利的一位科学家合成的一种新型氧分子,一个分子由四个氧原子构成,在相同条件下,等质量的O4和O3氧原子数之比为;两种气体的体积之比为。
(2)已知下列几种物质①氨气②液氯③硫酸④盐酸⑤酒精⑥烧碱⑦氢氧化铁胶体,其中属于电解质的
是(填写序号)。
(3)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:
物质A的化学式为;制备粗硅的反应为置换反应,且生成的气体具有还原性,该反应的化学方程式为 (提示:石英砂的主要成分是SiO2)。
实验室需要配制240mL 1.0 mol·L-1的NaOH溶液。试回答以下有关问题:
(1)该实验中至少需要称取氢氧化钠固体的质量为。
(2)该实验所需要的玻璃仪器,除烧杯、玻璃棒、量筒、胶头滴管外,还需要。
(3)烧碱溶解后未冷却至室温即转移定容,配得的溶液浓度将(填“偏大”、“偏小”或“无影响”,后同);定容时俯视刻度线,配得的溶液浓度将。
(1)造成水体污染的原因是。(填序号)
① 生活污水的任意排放② 工业废水的任意排放
(2)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:
_____。
(3)有机合成材料的出现是材料发展史上的一次重大突破。人们常说的三大合成
材料是指、和。