已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明氧化性:Cr2O72->I2 |
| D.实验③证明H2O2既有氧化性又有还原性 |
下列物质的转化在给定条件下能实现的是( )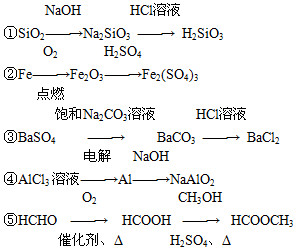
| A.①④⑤ | B.②③④ | C.②④⑤ | D.①③⑤ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.无色溶液:K+、Na+、Cu2+、SO42— |
| B.c(OH-)=10-13mol· L-1的溶液:Al3+、NO3—、I-、Cl- |
| C.水电离产生的c(H+)=10-13mol·L-1的溶液:Na+、Cl-、NO3—、SO42— |
| D.0.1 mol·L-1 FeSO4溶液:K+、NH4+、MnO4—、ClO- |
若用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
| B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA |
| C.常温常压下,20 g D2O含有的原子总数为3NA |
| D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA |
下列有关化学概念或原理的论述中,正确的是( )
| A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质 |
| B.任何一个氧化还原反应都可以设计为电池,输出电能 |
| C.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
| D.电解饱和食盐水的过程中,水的电离平衡正向移动 |
下列有关化学用语表示正确的是( )
| A.甲酸甲酯的结构简式:CH2O |
B.Na+的.结构示意图: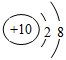 |
C.质子数为53、中子数为78的碘原子: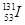 |
D.CO2的电子式为: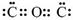 |