元素周期表的用途广泛。
(1)用“>”或“<”填空:
| 离子半径 |
非金属性 |
熔点 |
沸点 |
| K+_____S2- |
N____O |
金刚石_____晶体硅 |
HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液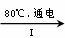 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂。Na2S2O3易溶于水,在酸性溶液中会迅速发生反应。
(1)完成Na2S2O3溶液与稀硫酸混合反应的化学方程式:
该反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5mL):
| 实验 编号 |
T/K |
c(Na2S2O3)/mol·L-1 |
c(H2SO4) /mol·L-1 |
实验目的 |
| ① |
298 |
0.1 |
0.1 |
实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响。 |
| ② |
308 |
① |
② |
|
| ③ |
③ |
0.2 |
④ |
|
| ④ |
⑥ |
0.1 |
⑥ |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为_______________________。(S元素被氧化为SO42-)
丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l)△H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g)△H2= -566kJ/mol
(1)写出表示丙烷气体燃烧热的热化学方程式
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则υ(H2)=,此过程吸收的热量为_____________。
(3)对于反应CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是。
①体系的压强不再发生变化②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥υ(CO2)正=υ(H2O)逆
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)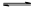 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A. B.密闭容器中总压强不变
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:_______________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(2)已知:NH2COONH4+2H2O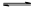 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。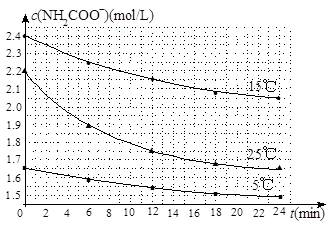
④计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_____________________。
⑤根据图中信息,如何说明水解反应速率随温度升高而增大:_________________。
我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油。甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g) 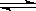 CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。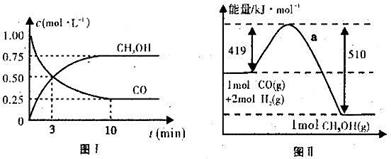
请根据图示回答下列问题:
(1)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_______________。
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b。
(3)写出该反应的热化学方程式。
(4)该反应的平衡常数K的表达式为;当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(5)恒容条件下,下列措施中能使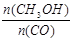 增大的有。
增大的有。
A.升高温度 B.充人He气
C.再充入1molCO和2molH2 D.使用催化剂
(6)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡(填“逆向移动”、“正向移动”、“不移动”)
(7)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容器 |
甲 |
乙 |
丙 |
| 投料量 |
1mol CO 、2mol H2 |
1molCH3OH |
2molCH3OH |
| CH3OH的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
吸收Q3kJ |
| 体系压强(Pa) |
P1 |
P2 |
P3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
则下列关系正确的是
A.c1= c2 B.Q3= 2Q2 C.2 P1<P3
D.α1+α2=1 E.2α2=α3
E.2α2=α3
F.该反应若生成1molCH3OH放出的热量为(Q1+ Q2)kJ
(8)若在一体积可变的密闭容器中充入1mol CO、2mol H2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向(填“正”、“逆”)反应方向移动,理由是
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)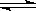 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表,回答下列问题:
| T℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
(1)该反应正向为ΔH0;若该反应符合如图所示的关系,则在图中,Y轴是指。(答出一种即可)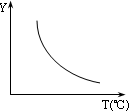
(2)能判断该反应达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为℃。其它条件不变,升高温度,原化学平衡向反应方向移动(填“正”或“逆”),容器内混合气体的平均相对分子质量(填“增大”、“减小”或“不变”)。