(14分) 二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)已知:
| 化学键 |
H-H |
C-O |
C=O |
H-O |
C-H |
| 键能/kJ·mol-1 |
436 |
326 |
803 |
464 |
414 |
计算上述反应的△H= kJ.mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是 (填选项字母)。
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
| 相同时间内CO2转化率 |
T1 |
T2 |
T3 |
T4 |
T5 |
| 反应Ⅰ |
65% |
77% |
80% |
80% |
66.67% |
| 反应Ⅱ |
56% |
67% |
76% |
80% |
66.67% |
| 反应Ⅲ |
48% |
62% |
72% |
80% |
66.67% |
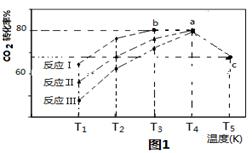
(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是 (填“反应I”,“反应II”,“反应III”)。
②T3的b点v(正) v(逆)(填 “>”, “<”, “="”" )。
③T4的a点转化率比T5的c点高的原因是 。
④在温度为T5时,该反应的平衡常数K= 。
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。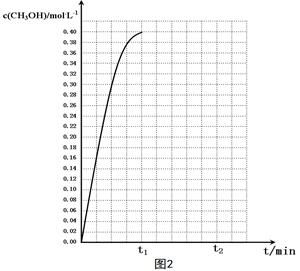
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH

(1)请回答图中甲、乙两池的有关问题:甲池是装置,B(石墨)电极的名称是。
(2)写出电极反应式:通入O2的电极的反应式。A(Pt)电极的反应式为,
(3)乙池中反应的化学方程式为。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O2体积为(标准状况下);
②乙池中所得溶液的pH=。
某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用作指示剂。
(2)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为mL;反应达滴定终点时的现象为。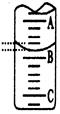
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是。
| A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积 |
| B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液 |
| C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗 |
| D.锥形瓶预先用食用白醋润洗过 |
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=mol/L。
(12分)右图是铜锌原电池装置。其电池的总反应是:
Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。
请回答以下问题: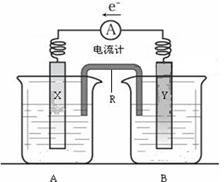
(1)R的名称是__________________,R中的阳离子移向_______(填A或B)中的溶液。
(2)电极Y的材料是________,B中的电解质溶液是________________。
(3)X为原电池的______极,其电极反应式是____________________________。
在一恒容密闭容器中发生某化学反应2A(g)  B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为
mol·L-1min-1。
(2)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(3)若将实验Ⅰ中A的起始浓度改为0.8 mol·L—1,其它条件不变,与实验Ⅰ相比,则达平衡时所需时间________实验Ⅰ(填写“大于”、“等于”或“小于”)。
(4)实验Ⅱ和实验I相比,可能隐含的反应条件是____________________。
A.升高温度 B.增大压强 C.使用了催化剂 D.增大A的浓度
(5)800℃时,A达平衡时的转化率为,此温度下该反应的化学平衡常数K值为
(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)= 2NO2(g)△H =" +67.7" kJ/mol;
N2H4(g)+ O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为__________________。
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为酸(填“强”或“弱”), H2A的电离方程式为,该溶液中由水电离出的c(H+)= 。
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b