(12分)已知实验室制取C12的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成C12;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为 。
(2)PbO2不稳定,随温度升高按下列顺序逐步分解:PbO2→Pb2O3→Pb3O4→PbO。若加热分解后所得到的固体全部为Pb3O4,现将a molPbO2加热分解,则加热过程中放出O2__ ___L(标准状况下);
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4+2CH3COONH4= (CH3COO)2Pb+(NH4)2SO4。
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为。
(2)25℃时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①25℃时,该反应的平衡常数为;
②下列情况不是处于平衡状态的是:
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在120℃进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时v(正)v(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。
①b点时,溶液中发生水解反应的离子是;
②在c点,溶液中各离子浓度由大到小的排列顺序是。
(14分)研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义。
(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为____________。
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是:_________________。
(2)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
①电源负极为_______极(填A或B):
②写出阴极室发生反应依次为:______________________、______________________;
(3)已知:
2SO2(g)+ O2 (g)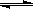 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 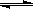 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 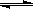 SO3 (g) +NO(g)的△H = kJ·mol-1
SO3 (g) +NO(g)的△H = kJ·mol-1
一定条件下,将体积比为1:2的NO2(g)、 SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
(15)H、C、N、O、Na、Cr是常见的六种元素。
(1)C位于元素周期表第____周期第___族;Cr的基态原子核外电子排布式为___________;C2H2分子中σ键与π键数目之比为____________。
(2)用“>”或“<”填空:
| 电负性 |
键长 |
键的极性 |
沸点(同压) |
| C_____N |
C=C_____C-C |
N-H____O-H |
甲醇____丁烷 |
(3)25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s)ΔH=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式_________________________。
(4)我国已经立法规定酒驾入列。“酒精检测仪”中有红色CrO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为______________________________________。
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是(填字母编号)。
| A.Na2CO3 |
| B.NaHCO3 |
| C.NaAlO2 |
| D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
300 |
500 |
700 |
| K |
3.00 |
3.47 |
4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:
①催化剂b表面的电极反应式为。
②经测定,若每分钟通过质子交换膜的H+的物质
的量为40mol,则每小时可产生O2Kg。
短周期元素N、Na、Al形成的物质在工农业生产、生活中应用广泛。
(1)Al在元素周期表中的位置为;其原子半径比Na(填“大”或“小”)。
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物。该化合物的晶体类型为;该化合物遇酸碱易被腐蚀,请写出它与NaOH溶液反应的离子方程式。
(3)NH3的电子式为;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是。
(4)标准状况下22.4L NH3与0.5L 1mol/L 氮元素的最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是。
(5)NF3是一种新型电子材料,常温下为稳定气体,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和某种物质。请写出反应的化学方程式。