(1)将复杂硅酸盐改写成氧化物形式:KAlSi3O8:________________。
(2)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
①将白色粉末加水溶解,得无色溶液。
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
①A的化学式是 B的化学式是 。
②原白色粉末中一定含有 ,可能含有 ,对可能含有的物质,可通过 (填实验名称)进一步检验。检验操作步骤有:①蘸取待测液②置于酒精灯火焰上灼烧 ③透过蓝色钴玻璃观察 ④用稀盐酸洗净铂丝。其中正确的操作顺序为 。
A.①②③④ B.④①②③ C.④②①②③④ D.①③②④
目前地球环境污染问题越来越严重,如温室效应、臭氧层破坏、烟雾事件、酸雨的形成、有毒物质的污染等已成为目前世界各国人民普遍关心的问题。请回答下列问题:
(1)产生温室效应的原因主要是大气中含有
A、SO2 B、NO2 C、CO2 D、CO
(2)臭氧层的破坏导致紫外线对地球表面辐射量增加,从而使全球皮肤癌的发病人数明显增加。造成这一现象的主要原因是
A、人们大量使用氟氯代烷
B、人们在炼钢时向空气中排放了大量的高炉煤气
C、石油炼制厂排放了大量的甲烷、氢气
D、硫酸、硝酸工厂排放了大量的二氧化硫和一氧化氮
(3)在20世纪60年代,一些工业发达国家的城市都发生过烟雾事件,并造成数以千计的人死亡。造成这一现象的主要原因是
A、汽油的不完全燃烧 B、大量使用了农药化肥
C、白色塑料垃圾的漂浮 D、金属矿物的冶炼
阿司匹林的结构简式如图:
根据这一信息,回答下列问题:
(1)写出阿司匹林的分子式:
(2)根据结构,推测阿司匹林的性质,下列试剂中,不能与阿司匹林反应的是
| A.氢氧化钠溶液 | B.硫酸钠溶液 | C.碳酸钠溶液 | D.稀硫酸 |
已知有以下物质相互转化。试回答: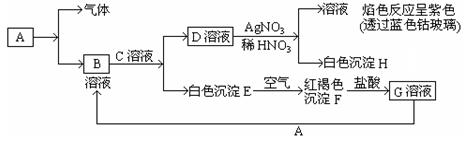
(1)写出B的化学式,D的化学式。
(2)写出由D转变成H的离子方程式。
(3)写出用KSCN鉴别G溶液的现象为;向G溶液加 入A的有关离子反应方程式。
入A的有关离子反应方程式。
(1)请填写下列空白处:实验室里要配制500mL0.2mol/L的硫酸钠溶液。实验步骤大致有:
| A.在天平上称出___________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 |
| B.把得到的溶液小心地沿着__________注入________mL的容量瓶中。 |
| C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 |
| D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用_______________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。 |
E、将瓶塞塞紧,充分摇匀。
F、将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2) 下列情况会使所配溶液浓度偏高的是___________(填序号)。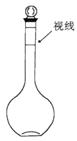
a、某同学定容时观察液面的情况如上图所示
b、没有进行上述的操作步骤C
c、加蒸馏水时,不慎超过了刻度线
d、所用砝码生锈
e、容量瓶用前内壁沾有水珠
(6分)(1)元素最高正化合价为+6,其负化合价为______,某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物化学式为____
(2)下列有关物质的比较,请用“>”“<”“=”填空
酸性:H3PO4__________HNO3,H2SO4 ________HClO4
________HClO4
热稳定性:CH4________NH3,HCl____________HI