空气中氧气含量测定的再认识。
【实验回顾】实验室用红磷燃烧来测定空气中氧气含量。
(1)写出红磷燃烧的化学方程式 (33) 。
(2)实验原理:红磷燃烧消耗氧气,使瓶内 (34) 减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。

【问题提出】有资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
【实验改进】
Ⅰ. 根据铁在空气中生锈的原理设计右图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
Ⅱ.测得实验数据如下表
| 测量项目 |
实验前 |
实验后 |
|
| 烧杯中 水的体积 |
烧杯中 剩余水的体积 |
集气瓶(扣除内容物) 和导管的容积 |
|
| 体积/mL |
80.0 |
54.5 |
126.0 |
【交流表达】
(1)铁生锈过程首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式 。
(2)根据表中数据,改进实验后与铁反应的氧气为 mL,空气中氧气的体积分数是 (计算结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因可能是: 。
某化工厂排放的废液中含有大量的硫酸锌和硫酸铜,化学兴趣小组的同学根据所学知识设计了一个方案,用来回收金属铜并得到硫酸锌晶体,主要过程如下图所示: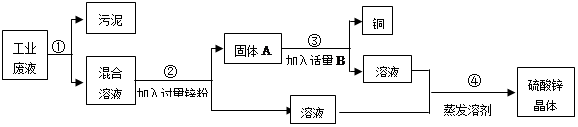
请回答下列问题:
(1)步骤②中分离物质的方法是,发生反应的化学方程式为。
(2)固体A的成分是。
(3)步骤③中加入的B物质是。
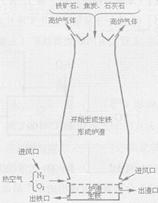
甲图是利用一氧化碳与氧化铁反应装置的示意图,乙图是高炉炼铁示意图。请回答下列问题:(A处为澄清石灰水)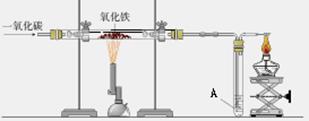
甲乙
(1)甲图实验过程中,先要进行的是(填Ⅰ或Ⅱ)Ⅰ:加热Ⅱ:通入CO
(2)甲图中硬质玻璃管里发生反应的现象是 ,观察到A处出现的现象是 ,其中发生的化学反应方程式是 。
(3)甲图中实验要在装置末端a处燃着一盏酒精灯,其作用是 ;其中发生的化学反应方程式是 。
(4)乙图中高炉炼铁时焦炭的作用是 。
(5)为什么乙图中出铁口低于炉渣出口?。
(6)化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数。
某同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(氢氧化钠溶液可以吸收二氧化碳气体)。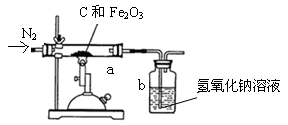
①实验中持续通入干燥的氮气。加热前缓缓通入一段时间,其作用是 。
②停止加热前是否需要先断开a和b的连接处以防止倒吸?为什么?
。
(7)试计算:我国铁矿石资源比较丰富,某钢铁厂用1000 t 含氧化铁80% 的赤铁矿石,理论上可以炼出含铁96% 的生铁的质量是多少?(保留一位小数)
下图所示为实验室常用的实验装置: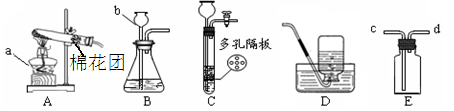
(1)写出下列仪器名称:a;b。
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是(填装置的字母代号),化学方程式是,用双氧水制取氧气的化学方程式为。
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是,若将E装置中收集的氢气排出,应从(填c或d)口通入蒸馏水。
(4)装置C相对于装置B在操作方面的优势为。
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一] 探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| 甲 |
乙 |
|
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为: ①>②>③。 |
 |
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 Ⅱ 对比甲同学实验①②可知,,化学反应的速度越快; Ⅲ 对比甲同学实验(填实验序号)可知,反应物的接触面积越大,反应速率越。 Ⅳ 乙同学的实验中,数据记录纸上应该连续记录的实验数据是和。 |
[拓展实验二] 测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和。)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。下图(Ⅰ)为石头纸与稀盐酸反应的装置,图(Ⅱ)用于测量CO2的体积。
① 连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置(I)气密性(选填“良好”或“漏气”)
② 图(Ⅱ)装置中油层的作用是_;
③ 反应停止后,(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
A. 水平移动量气管 B.上下移动量气管 C. 封闭量气管
(7) 乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
| 第一份 |
第二份 |
第三份 |
第四份 |
|
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题:
① 在第1份样品的实验中,完全反应了。
② m为
③ 石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程,4分)
④ 请在坐标图中画出在6.25 g样品中加入稀盐酸的体积与产生气体质量的关系图。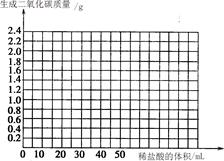
小强同学分别取溶质质量分数相同的稀盐酸,大小、形状都相同的某种金属X、Al、Cu 进行实验,实验现象记录如下:
| Al |
X |
Cu |
||
| 现象 |
开始时 |
几乎无气泡产生 |
产生气泡速律慢 |
无气泡产生 |
| 一段时间后 |
产生气泡速律快 |
产生气泡速律慢 |
无气泡产生 |
回答下列问题:
(1)实验开始时,铝表面几乎无气泡产生的原因是。
(2)Cu表面始终无气泡产生的原因是。
(3)三种金属的活动性由强到弱的顺序是。
(4)如果金属X的活动性比铁弱,且金属X与稀盐酸反应后生成易溶于水的XCl2。向只含有XCl2、CuCl2两种溶质的溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中加入稀盐酸,没有气泡产生。则滤液中一定含有的金属阳离子是(用离子符号表示)。
暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 |
形成的原因 |
| 可能是CaCO3 |
石灰水与空气中CO2反应; 化学方程式为: |
| 可能是 |
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
经过反复思考,同学们认为白色粉末还可能是的混合物。
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解。于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是:。
| OH- |
Cl- |
CO32- |
NO3- |
|
| Ca2+ |
微 |
溶 |
不 |
溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实验步骤 |
可能观察到的现象 |
结论 |
| ①取上述试管中上层清液,滴加1~2滴无色酚酞试液 |
①。 |
②。 |
| ②往上述试管中的残留的固体中加入稀盐酸 |
③。 |
④白色粉末中(选填“有”或“无”)CaCO3 |
| ③由上述实验可知白色粉末的成分是:。 |
(3)交流与反思:
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是(选填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂