氧气是生产生活中重要的物质。
(1)氧气有很多用途。下列属于氧气用途的是 和 (填序号)。
| A.医疗急救 | B.食品防腐 | C.航天火箭 | D.霓虹灯 |
(2)氧气能跟很多物质反应。根据下图所示实验,并阅读资料,回答下列问题。

Ⅰ.小明对图1铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
| 物质 |
镁条 |
含碳0.05%的铁丝 |
含碳0.2%的铁丝 |
含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
未填 |
①表中“未填”部分的内容应为__ ___;
②铁丝在氧气燃烧的文字表达式是___ 。
集气瓶底部放少量水或细沙的作用是______________________
③通过以上探究,你认为铁丝燃烧产生火星四射现象的原因可能是__ ____。
Ⅱ.图2中的反应现象为 ,反应的文字表达式为 ,集气瓶中加入的液体可能是 ,其主要目的是___ 。
某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O=2NaOH+H2↑+Cl2↑),这种工业成为“氯碱工业”,某研究性学习小组对该厂生产的烧碱样品进行如下探究。
I.定性探究
【提出问题】烧碱样品中含有哪些杂质?
【猜想】猜想一:可能含有Na2CO3,作出此猜想的依据是(用化学方程式表示)猜想二:可能含有NaCl,作出此猜想的依据是(用简洁的文字表述)。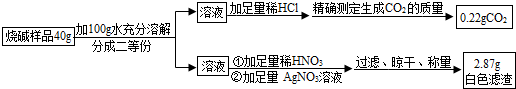 II.定量探究
II.定量探究
【提出问题】烧碱样品中氢氧化钠的质量分数是多少呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
请你利用小婉同学测得的数据计算烧碱样品中氢氧化钠的质量分数(请列出计算过程)。
【交流与反思】小强同学认为小婉同学设计的探究方案不够严密,其理由是:
(1)探究方案中没考虑氢氧化钠的吸水性。
(2)探究方案中因缺少(填操作名称),导致测得的氢氧化钠的质量分数偏小。
实验室有三瓶没有标签的无色溶液,它们分别是稀硫酸、硫酸钠溶液、碳酸钠溶液。设计一个实验方案,把这三瓶溶液进行鉴别,并完成实验报告。(可供选用的试剂有:酚酞溶液、生锈铁钉、氯化钡溶液)
| 实验步骤 |
预期现象与结论 |
| (1) |
|
| (2) |
小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验。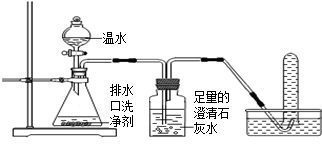
A B C
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是:(填化学式)。B中有关反应的化学方程式是。
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: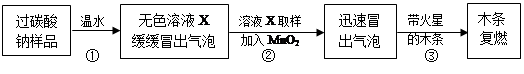
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设: 根据以上实验现象,X溶液中一定存在的溶质是;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl。
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
| 实验操作 |
主要实验现象 |
结论 |
| ① |
证明溶液中有Na2CO3 |
|
| ② |
证明溶液中无NaHCO3 |
|
| ③ |
证明溶液中无NaOH |
(6)实验反思:根据资料,NaHCO3溶液能与石灰水反应生成白色沉淀。于是,同学们猜想:碳酸氢钠与氢氧化钠是否可以发生(写方程式)这样的反应?于是,同学们进行了新的探究实验。
根据下图中所示装置回答下列问题: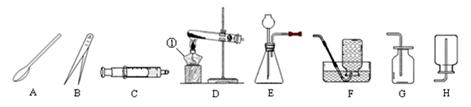
(1)写出图中标示的仪器名称:①。
(2)实验室用KMnO4制取O2,应选用的发生装置为(填字母序号,下同),收集装置可选用(写一种即可),取用KMnO4固体时,应选用的仪器,写出该反应的化学方程式。
(3)注射器C可用于检查装置E的气密性,步骤如下:
①向锥形瓶中加入少量水至没过长颈漏斗下端处。②将注射器C连接到装置E的导管口处。
③缓慢拉动注射器C的活塞,观察到,表示装置E的气密性良好。
(4)实验室用装置E制取CO2时,如用注射器C替换长颈漏斗,优点是
。
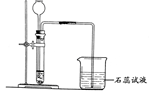
某化学兴趣小组利用下列装置进行O2、CO2、H2的实验室制法和有关性质的研究。回答下列问题: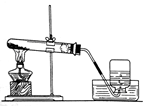

AB C
(1)甲同学用KMnO4固体制取O2,选用上图中的__装置(填序号),该反应的化学方程式是。
(2)乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红。对这一变化的合理解释是_________________(填序号)。
A.产生的CO2直接使石蕊试液变红
B.产生的CO2与水反应生成H2CO3使石蕊试液变红
C.挥发出的氯化氢溶于水使石蕊试液变红
(3)丙同学用C装置制取了一瓶H2,写出用C装置制取H2的药品_______________________。