【2015年广西省南宁市】某化学兴趣小组的同学对实验室制取二氧化碳及相关性质进行一系列的探究活动。
(1)气体制取
按如图1所示的制取装置进行实验。
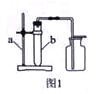
①写出有标号仪器的名称:a ,b 。
②实验室制取二氧化碳的反应化学方程式是 。
③实验室收集二氧化碳的方法是 ,原因是 。
(2)实验研究
【提出问题】实验室制取二氧化碳时能否采用排水法收集?
【设计实验】
实验一:向一个充满二氧化碳气体的质地较软的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,用力摇晃塑料瓶。可观察到塑料瓶 ,说明二氧化碳能溶于水。
实验二:先用集气瓶装满一瓶蒸馏水(pH=7.0),然后按如图2所示组装组装并进行实验,再用pH计测定从装置C排到烧杯中的液体的pH。
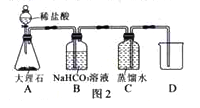
①装置B中碳酸氢钠溶液的作用是 。
②测得烧杯中液体的pH<7.0,说明溶液呈酸性,原因是 。
【实验结论】实验室制取二氧化碳不宜采用排水法收集。
【拓展延伸】某同学先对图2装置做了以下改进:将装置C中的部分蒸馏水换成植物油,将烧杯换成量筒(如图3所示),然后利用改进后的装置测定收集到二氧化碳的体积,测得气体的实际体积小于理论值,原因可能是:
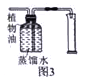
① ,② 。(合理即可)
在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.
(1)贝壳高温煅烧时,发生反应的化学方程式是;
(2)操作Ⅰ中用到的玻璃仪器有烧杯、、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的
乙:
和
的混合物
丙:
和
的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 |
现象 |
结论 |
|
| 甲 |
取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 |
溶液变红 |
猜想成立 |
| 乙 |
取少量固体C,溶于适量水形成溶液后,滴加足量 | 无气泡产生 |
猜想不成立 |
| 丙 |
取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液 |
猜想成立 |
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
[查阅资料]
| 名称 |
食用纯碱 |
食用小苏打 |
| 主要成分 |
|
|
| 酸碱性 |
水溶液显碱性 |
水溶液显碱性 |
| 热稳定性 |
受热不分解 |
270℃时完全分解为碳酸钠、二氧化碳、水 |
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变色,但食用纯碱溶液中颜色更深,由此推测可能溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用进行测定.
(2)验证两种粉末的稳定性
在老师的指导下,该小组按如图1装置进行实验操作,观察到(填"甲"或"乙")烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为,装置中棉花的作用是.
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用如图2装置进行实验测定.
数据记录如下:
| 称量项目 |
称量时间 |
质量/g |
| 试样 |
11.0 |
|
| 装置+稀盐酸 |
160.0 |
|
| 装置+稀盐酸+试样 |
反应开始后20s |
167.0 |
| 装置+稀盐酸+试样 |
反应开始后30s |
166.6 |
| 装置+稀盐酸+试样 |
反应开始后90s |
166.6 |
②通过计算确定食用纯碱粉末中
的质量分数.(写出计算过程,结果保留一位小数.)
③如果测得的结果比实际纯度高,可能的原因是.(答一种即可)
某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验:
I.将3.0
与1.0
均匀混合加热
II.将
与1.0
均匀混合加热
在相同温度下,比较两组实验产生
的快慢.
I中反应的化学方程式是;II中
的值为.
②乙探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 |
双氧水的浓度 |
的质量 |
相同时间内产生
的体积 |
|
| I |
50.0 | 1% |
0.1 | 9 |
| II |
50.0 | 2% |
0.1 | 16 |
| III |
50.0 | 4% |
0.1 | 31 |

实验结论:在相同条件下,,双氧水分解得快.
丙用如图装置进行实验,通过比较也能达到实验目的.
某品牌纯碱中含有少量氯化钠.某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验:
【设计实验方案】
实验装置(如图2所示,固定装置略去);
需要测定的实验数据:纯碱样品的质量;实验前、后装置(包括氢氧化钠固体)的总质量.
(1)
装置中反应的化学方程式为;为了保证纯碱样品中的碳酸钠完全反应,其操作是.
(2)
装置的作用是;
装置中反应的化学方程式为.
(3)补充
装置(简要叙述或画出装置示意图).
【交流与表达】
(4)有同学认为图2所示实验装置会造成测得纯碱的纯度偏低,原因是.
(5)为了克服图2装置的不足,有同学提出,还应增加图1装置与
装置连接(
装置中原双孔橡胶塞换成三孔橡胶塞),在反应前、后用图1装置分两次缓缓鼓入足量空气.
①反应前,断开
、
装置之间的连接,用图1装置鼓入空气的作用是;
②反应后,用图1装置鼓入空气的作用是;
③在
装置中的反应发生时,开关
处于关闭状态,其原因是.
【数据处理】
(6)称得的纯碱样品质量为10.8
,实验前、后
装置的总质量分别为75.2
和79.6
,纯碱的纯度为%(计算结果保留小数点后一位).
【反思与评价】
(7)能否用稀盐酸代替稀硫酸?同学们经过讨论认为不能,理由是.
(8)改进后的实验装置能减少测定的误差,原因是①反应生成的
尽可能被
装置吸收;②.
.小明设计了图1所示的实验装置,进行一氧化碳还原氧化铜的实验。试回答:
⑴该装置的不足之处是。
⑵实验开始时,先要进行的操作是
(选填序号:①加热 ②通一氧化碳)。
⑶实验过程中,B处反应的化学方程式是。
Ⅱ.为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了图2的装置(铁架台、铁夹等装置已略去,a、b为活塞)。
⑴当关闭活塞b,打开活塞a时,可分离得到(写化学式,下同)。
⑵然后关闭活塞a,再打开活塞b,又可分离得到。
Ⅲ.对于A装置中反应后得到的红色固体(此时氧化铜已全部反应完),
小明进行了以下探究
【查阅资料】①氧化铜经一氧化碳还原不仅能生成铜,还可能生成氧化亚铜(化学式为Cu2O)。②Cu2O是不溶于水的红色固体,在酸性溶液中,可发生反应生成Cu2+和Cu。
【提出猜想】氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O。
【进行实验】小明设计了一个最简单的实验方案证明自己的猜想。
| 实验步骤 |
|
| 实验现象与结论 |
|
| 化学方程式 |