在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.

(1)贝壳高温煅烧时,发生反应的化学方程式是;
(2)操作Ⅰ中用到的玻璃仪器有烧杯、、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的
乙:
和
的混合物
丙:
和
的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 |
现象 |
结论 |
|
| 甲 |
取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 |
溶液变红 |
猜想成立 |
| 乙 |
取少量固体C,溶于适量水形成溶液后,滴加足量 | 无气泡产生 |
猜想不成立 |
| 丙 |
取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液 |
猜想成立 |
通过学习我们知道,在化学变化中物质发生了改变,但质量是否改变了呢?为此某校甲、乙两个兴趣小组对这个问题进行了探究,过程如下:
【提出问题】参加反应的反应物总质量与生成物总质量是否相等
【实验方案】甲、乙两个兴趣小组分别设计了如图所示的实验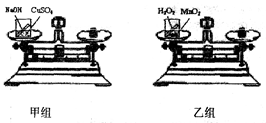
【进行实验】如图所示,甲小组把盛有适量NaOH溶液的小试管放入盛有CuSO4溶液的烧杯中,乙小组把盛有适量H2O2溶液的小试管放入盛有MnO2的烧杯中;然后将烧杯放到天平上调至平衡;接着取下烧杯并将其倾斜,使物质混合发生反应,待反应后再把烧杯放到天平上,观察天平是否平衡。
【实验现象】反应后,甲小组的天平指针指向刻度盘的(填“左边”、“右边”或“中间”),乙小组的天平指针指向刻度盘的右边。
【解释与结论】甲小组的结论为:,
化学方程式为CuSO4+2NaOH===Cu(OH)2↓+Na2SO4。乙小组的指针偏向右边是因为。
【反思与与评】比较两个小组的实验设计,你得到的启发是。
(10分)下图中的甲、乙两套装置都可以用来探究可燃物燃烧的条件。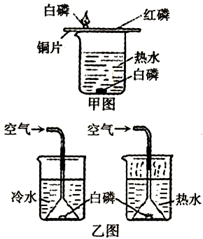
(1)某同学用甲图所示的装置进行探究实验,观察到的现象是该反应属于(填“化合”或“分解”)反应。
(2)另一同学用乙图所示的装置进行了探究实验,得出了以下四个实验事实:
①不通空气,热水中的白磷不能燃烧
②不通空气,冷水中的白磷不能燃烧
③通空气,热水中的白磷能燃烧
④通空气,冷水中的白磷不能燃烧
比较(填序号)两个实验可以得出“可燃物燃烧需要与空气接触”的结论;比较(填序号)两个实验可以得出“可燃物燃烧需要达到一定温度(着火点)”的结论。
(3)甲图与乙图所示实验相比,(填“甲”或“乙”)更体现了化学实验的绿色化追求。
(4)同学们查阅资料获取到这样一条信息:“点燃的镁带可以在二氧化碳气体中继续剧烈燃烧,生成碳和氧化镁”。
请写出该反应的化学方程式:你对燃烧或灭火有什么新的认识
某兴趣小组同学阅读课外资料得知:很多物质都能影响过氧化氢分解速度。于是,同学们探究催化剂对过氧化氢分解速度的影响。分别取相同质量和浓度的过氧化氢溶液加入不同质量的MnO2,测量相同时间内收集氧气的体积。
【实验过程】实验数据记录如下:
| MnO2的质量 |
测量数据 |
|
| Ⅰ |
0.1g |
9 mL |
| Ⅱ |
0.2g |
16 mL |
| Ⅲ |
0.4g |
31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式______________________________________。
(2)本实验中,测量O2体积的装置是________(填编号)。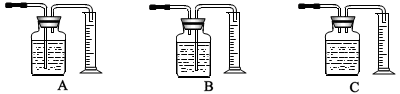
【实验结论】在其他条件相同的情况下____________________________________。
【交流评价】
有同学提出在上述实验中测量______________同样能得出相同的结论。
【实验反思】
除了催化剂的质量会影响过氧化氢分解速度外,催化剂的_________(写一种)也会影响过氧化氢分解速度,你的实验方案是____________________________________。
某实验小组同学对双氧水制氧气的若干问题进行探究。
(1)利用图甲中A、B仪器可以组装一套测量氧气体积的装置,该装置导管的连接顺序是 接C(填接口编号)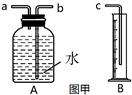
(2)A瓶中原有的空气对氧气体积测定(填”有或没有”)影响?
(3)图乙装置也可以用来测量反应中生成的氧气体积。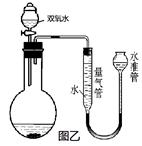
为了较准确的测量氧气体积,在读取量气管中液面读数时,应注意哪些问题?, 。(答两点)如管中出现左低右高,应将水准管(填“上移”,“下移”“不动”)
某校初三化学学习小组的同学前往某地的石灰石矿区进行调查,他们取回矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:
甲组同学:
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。右图为大理石与稀盐酸反应的反应装置,并测量CO2的体积。(其他仪器省略)
(1)下图中左侧的橡皮管的作用是。下图中装置中油层的作用是。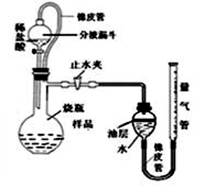
(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
乙组同学:
【查阅资料】1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分
取样品,研成粉状后,按下图进行实验。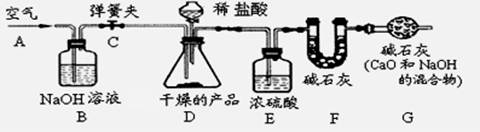
(1)实验步骤:
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量;
④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次快速通一段时间空气;
⑥称量F的质量,计算前后两次质量差。最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:
①产品研成粉状的目的;
②B装置的作用是;
G装置的作用是。
③若没有E装置,则测定的CaCO3的质量分数会(填“偏大 偏小 不变”)。
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的是。
总结反思:
(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因是。
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因是。