本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
化学与社会经济建设、生态文明建设、人类健康保障等密切相关。
(1)材料是经济和生态文明建设的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 。
②橡胶是制造轮胎的重要原料,橡胶属于 (填字母)。
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生 腐蚀。发生该腐蚀时的负极反应式为 。
(2)防治环境污染,改善生态环境已成为全球共识。
①2013年,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是 (填字母);
A.O2 B.CO2 C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾.
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧处理前,除废电池外,还有 (填字母)应剔除并回收,随意丢弃电池造成的主要危害是 。
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是 。
(3)保证食品安全、保持营养均衡,是保障人体健康的基础。
①维生素C能促进人体生长发育。下列富含维生素C的是 (填字母)。
A.牛肉 B.辣椒 C.鸡蛋
②缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是
A.碘 B.铁 C.钙
③人体内蛋白质在蛋白酶作用下,水解为 ,在鸡蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为 。
④使用青霉素可能会产生过敏,在用药前患者一定要进行 。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸 反应。回答下列问题:
反应。回答下列问题:
(1)组成单质Y的元素在周期表中的位置是;M中存在的化学键类型为; R的化学式是。
R的化学式是。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为。
(3)写出A和D的稀溶液反应生成G的离子方程式:。
(4)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,则n(X2+)的最大值为。
已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题。
(1)D元素原子的结构示意图为;
(2)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
(3)A、B、C三种元素的原子半径由小到大的顺序为;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-离子,当向该溶液加入某浓度的NaOH溶液时,发现生成沉淀的物质的量 随NaOH溶液的体积变化如图所示,
随NaOH溶液的体积变化如图所示,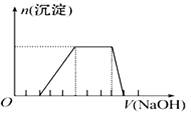
由此可知,该溶液中肯定含有的阳离子是_______________________,且各离子的物质的量之比为_____;肯定不含的阳离子是_____________。
在①H2S②SO2③CO④Cl2⑤HCl五种气体中,能使品红溶液褪色的是_______;通入石蕊试液先变红后褪色的是__________,只变红不褪色的是__________;能使碘化钾淀粉试纸变蓝的是__________;能与溴水反应的是__________。(填序号)
A、B、C、D均为有机化合物。请根据以下框图,回答问题:
(1)B不含有支链,则B的结构简式为,其中含有的官能团是。
(2)C含有支链,在浓硫酸作用下加热反应只能生成一种烯烃D(不考虑立体异构),则D的结构简式为,其名称(系统命名)是。
(3)C在催化剂Cu的作用下被氧气氧化为有机物E,E能发生银镜反应,则C的结构简式为。
(4)写出反应①的化学方程式:,其反应类型是。
(5)物质B有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:。
i)既能发生银镜反应,又能发生水解反应
ii)其核磁共振氢谱有三种类型氢原子的吸收峰