纳米级Cu2O具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。已知Cu+易在酸性条件下发生:2Cu+=Cu2++Cu。
方法一:在新制Cu(OH)2浊液中滴入N2H4·H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
(1)写出上述制备过程中的总反应方程式 。
(2)用甲醛稀溶液代替N2H4·H2O水溶液也可以实现上述转化,但需水温较高,且往往会生成极少量颗粒较大的Cu2O,用 的方法可分离出颗粒过大的Cu2O。
方法二:以铜作阳极,石墨作阴极电解。已知:①铜作阳极时,铜先被氧化生成Cu+,后Cu+继续氧化生成Cu2+;②在碱性溶液中CuCl浊液易转化为Cu2O。
(3)以NaOH溶液作为电解质溶液时需添加NaCl,其目的是 ,写出阳极反应方程式 。
(4)写出在碱性溶液中CuCl浊液转化为Cu2O的离子方程式 。
(5)这样制得的Cu2O中往往含有CuCl,请设计实验证明CuCl的存在 。
工业上制取冰晶石(Na3AlF6)的化学方程式如下,
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非电解质的物质的电子式为,属于弱酸的电离方程式。
(2)上述反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)上述反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为。
(4)上述产物当中有一个物质比同族元素类似化合物的沸点高很多,写出这个物质的结构式_______,其沸点较高的原因是_______________;反应物中属于盐的物质中含有的化学键有________________。(填“离子键”或“共价键”或“金属键”)
按下列要求填空(共12分)
①向碳酸氢钙溶液中加入少量氢氧化钠溶液的离子方程式:________________________。
氯化铝溶液与NaHCO3溶液混合的离子方程式:_____________________________________。
②在KClO3 + 6HCl =" KCl" + 3Cl2↑ + 3H2O的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是_______________。
③强酸性的未知无色溶液中可能含有大量的Cl-、S2-、NO3-、CO32-、NH4+、Cu2+、Fe3+、Ag+等,现已检出有Ag+,你认为其中 __ __离子还需要鉴定是否存在,请写出检验该离子的离子方程式_____________________。
④某化合物的相对分子质量为m,在t℃时AmL该化合物的饱和溶液为Bg,将其蒸干后得到固体Cg。该化合物在t℃时的溶解度 为 __g,该饱和溶液中溶质的物质的
为 __g,该饱和溶液中溶质的物质的 量浓度为mol/L。
量浓度为mol/L。
铝土矿的主要成分是A12O3,含有Fe2O3、
SiO2等杂质,按下列操作从铝土矿中提取A12O3。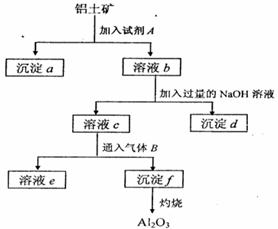
回答下列问题:
(1)沉淀物的化学式分别是: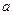
 ;d;
;d;
f;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式、
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式、。
(4)气体B能否改用试剂A代替?为什么?, 。
。
(共11分)抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2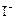 +2H+ =I2+2H2O
+2H+ =I2+2H2O
③CH3COOOH+2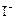 +2H+= CH3COOH+I2+H2O
+2H+= CH3COOH+I2+H2O
④I2+ 2S2O32- =2I-+ S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
(2)用单线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ =□Mn2 ++□O2↑十□H2O
++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0 L待测液,用硫酸使溶液酸化,再用浓度为a1 mol·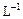 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·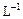 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·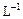 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)
已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,磁性黑色物质C是某金属矿物的主要成份,E是一种非氧化性酸,F是混合物,H是极易溶于水的碱性气体。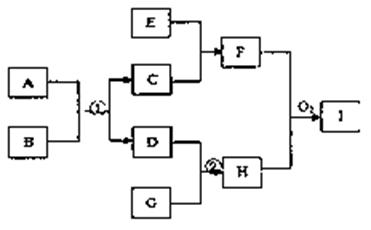
请回答下列问题:
(1)写出下列物质的化学式:A、C、I
(2)写出反应①的化学方程式:
写出生成混合物F的离子方程式:
(3)在一定温度、压强和有催化剂存在的条件下将l mol G和2,5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,
①则用G表示20min内的平均反应速率为:____
该温度下此反应的平衡常数K=,D的转化率为
②如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将(填“升高”、“不变”或“降低”),再次平衡后H的体积分数为____。