由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):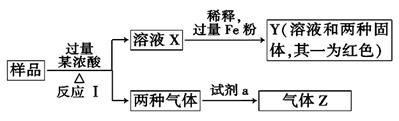
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)___________。
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_____________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)_____________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是_______________。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2﹣、SO42﹣、SiO32﹣、CO32﹣、Cl﹣中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)肯定不存在的离子是 .
(2)写出步骤②中生成沉淀和气体的反应的离子方程式 .
(3)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl﹣? (填“有”或“无”).
在一体积不变的密闭容器中进行如下反应:2X(g)+Y(g)  2W(g);反应前按n(X)∶n(Y)=3∶1加入反应物,反应过程中W的物质的量随时间的变化如图所示。
2W(g);反应前按n(X)∶n(Y)=3∶1加入反应物,反应过程中W的物质的量随时间的变化如图所示。
(1)分析曲线A和B的不同,可能是以下_____ ___原因造成的。
A.是否使用催化剂 B.反应温度不同
C.外界的压强不同 D.初始充入的反应物的物质的量不同
(2)该反应的化学平衡常数为K,比较K500℃___ _____K600℃(填“>”、“<”或“=”)。
(3)如果曲线B达到平衡时,体系的压强为反应前的85%,当容器的体积为1 L时,计算:曲线A从开始达到平衡,X的反应速率v(X)为____________。起始时加入Y的物质的量为______________mol。不通过计算能否判断出X、Y转化率是否相同_________________(填“能”或“否”)。
(4)说明该反应已达到平衡状态的是_________________。
A.v正(W)=v逆(W) B.c(X)=c(W)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
已知下列热化学方程式:
①H2O(l)===H2(g)+ O2(g) ΔH=+285.8 kJ/mol
O2(g) ΔH=+285.8 kJ/mol
②H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3 kJ/mol
④C(s)+ O2(g)===CO(g) ΔH=-110.5 kJ/mol
O2(g)===CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是_____ ___。
(2)C的燃烧热ΔH为______ __。
(3)燃烧10 g H2生成液态水,放出的热量为______ __。
(4)写出CO燃烧的热化学方程式________________________________
写出制水煤气的热化学方程式_____________________________________
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
| A.升高温度 | B.降低温度 |
| C.增大压强 | D.减小压强 |
E.加入催化剂 G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更重要的化工原料,反应的化学方程式为
(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。
(2)某温度,纯水中c(H+)=3×10-7mol/L,则纯水中c(OH-)= mol/L,此时在水加入稀硫酸至c(H+)为1×10-5mol/L则此时c(OH-)= mol/L