下列所含分子数由多到少的排列顺序是 。
| A.标准状况下33.6 L H2 |
| B.所含电子的物质的量为4 mol的H2 |
| C.20 ℃时45 g H2O |
| D.常温下,16 g O2与14 g N2的混合气体 |
E.含原子总数约为1.204×1024的NH3
X、Y、Z、W为原子序数依次增大的短周期元素.X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;X、Z处于同一主族,W的最外层电子数等于其电子层数.
(1)Y在元素周期表的位置是.Z在氧气中燃烧的产物所含化学键类型有.
(2)W元素的原子结构示意图是.Z最高价氧化物的水化物与W的最高价氧化物的水化物,碱性较强的是(填化学式).
(3)甲和Y的最高价氧化物的水化物反应生成乙.在0.1 mol·L-1乙溶液中,所含离子浓度由大到小的顺序是.
(4)25℃时,W的最高价氧化物的水化物KSP=1.0×10-34,使含0.1 mol·L-1 W离子的溶液开始产生沉淀的pH为.
(5)已知298K时:2Fe(s)+O2(g)="==" 2FeO(s)△H=-544.0kJ·mol-1
4W(s)+3 O2(g)===2W2O3(s) △H=-3351.4 kJ·mol-1
则W单质和FeO反应的热化学方程式为.
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为。平衡后可以采取下列的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为。平衡后可以采取下列的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g)△H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g)△H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式。
②该反应的△S0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是(填字母);理由是。列式计算270℃时该反应的平衡常数K:。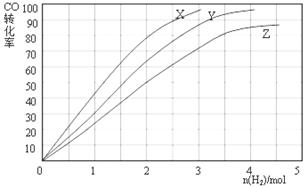
某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出X在元素周期表中的位置,写出Y2-的结构示意图
写出B的化学式
(2)写出气体C通入H2O2中反应的离子方程式
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理理由是
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物
)有机玻璃(PMMA)成分为聚甲基丙烯酸甲酯,因其透光性好、性能优良、价格低廉,广泛应用于商业,轻工、建筑、化工等方面,甚至人工角膜也是有机玻璃。其单体的结构和工业合成路线如图所示。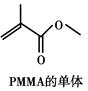
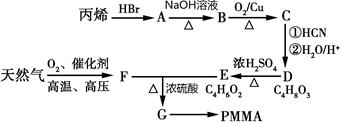
已知:(1)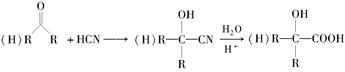
(2)R-Br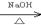 R-OH
R-OH
请回答下列问题:
(1)写出B中官能团名称,PMMA的结构简式。
(2)判断D→E的反应类型。
(3)写出E+F→G的化学反应方程式。
(4)写出C的一种能与新制氢氧化铜反应的同分异构体。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
①反应I的化学方程式为。
②反应Ⅱ的离子方程式为。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH=时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2(填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。