(16分)氮氧化合物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
2NO(g) + O2(g)  2NO2(g) ΔH
2NO2(g) ΔH
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g)  N2O2(g) ΔH1<0 ②__________________________
N2O2(g) ΔH1<0 ②__________________________
(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为___________________mol•L-1•s-1,该条件下反应:2NO + O2 2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO(g) + O2(g)  2NO2(g) ΔH______0(填“<”或 “>”);
2NO2(g) ΔH______0(填“<”或 “>”);

(3)2NO(g) + O2(g)  2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)
2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)  2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。

下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
| ⅠA |
0 |
|||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
④ |
||||||
| 3 |
⑤ |
③ |
⑥ |
⑦ |
(1)④、⑥、⑦的离子半径由大到小的顺序为。
(2)1971年美国科学家通过细冰获得含元素④的含氧酸(HXO),在与水反应时,两种分子中的共价键分别断裂成两部分,再重新组合,写出该反应的化学方程式。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气
体,D溶液显碱性。
①写出D溶液与G反应的化学方程式。
②常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为mol。
③若仅电解l L 0.1 mol/L A溶液,图中各步反应均为完全转化,而各物质在反应过程中没有损耗,则混合物X中含有的物质有。
现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如下图所示;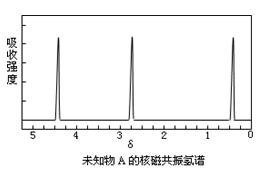
下图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。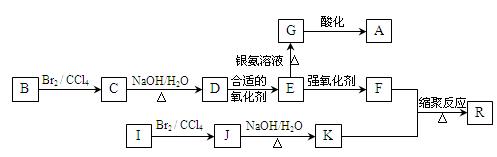
已知: 
②同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。
请分析并按要求回答下列问题:
(1)写出A对应的结构简式:;
(2)写出对应反应的化学方程式:
C→D:;反应类型为:______________________;
E→G:;
F+K→R:;
(3)有机物E的同分异构体M满足下列三个条件:
①1 mol有机物与银氨溶液充分反应生成2 mol Ag
②1 mol有机物与足量NaHCO3溶液反应产生1 mol CO2
③1 mol有机物与足量金属Na反应产生1 mol H2
请判断M的结构可能有种,任写一种M的结构简式。
下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构。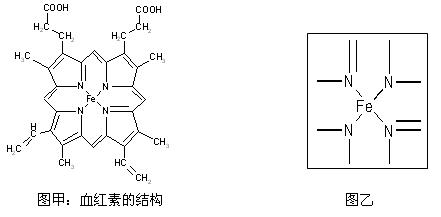
回答下列问题:
(1)血红素中含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是,根据以上电负性请判断H2N-CHO 中C和N的化合价分别为和。写出基态Fe原子的核外价电子排布图。
(2)血红素中两种N原子的杂化方式分别为,在上图乙的方框内用“→”标出Fe2+的配位键。
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为,δ、α两种晶胞中铁原子的配位数之比为;在δ晶胞中空间利用率为____________,其晶体的堆积方式的名称为,与其具有相同堆积方式的金属还有(填元素符号)。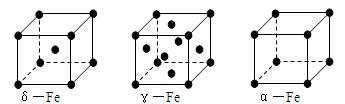
若X、 Y两种元素在周期表中位于同一主族,且相隔一个周期,并有m=n>0。在一定条件下有下列反应(未配平):Xm + Yn + H2O→ HXO3 + HY
请回答:(1)该反应的还原剂的电子式为___________________。
(2)配平上述化学方程式(用化学式表示):
(3)若某化学反应如下:(未配平)
KX+ Yn + H2O→ KXO3 + Xm+ HY + KY
若KXO3和Xm的化学计量数均为1,则Yn的化学计量数为____________。
在下面化学式上标出电子转移的方向和数目
KX+ Yn + H2O→
(4)已知:在反应中,若氧化反应和还原反应发生在同一分子内部处于同一化合价的同种元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。实验室模拟KXO3的制法如下: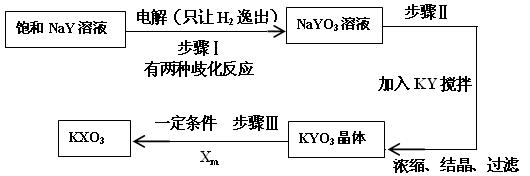
①在进行步骤Ⅰ实验时,有学生主张电解装置用U形管,有的学生主张用烧杯,你认为用哪种仪器更合适______________(填名称)。
②步骤Ⅰ的阴极电极反应式为(用化学式表示):_____________________。
③步骤Ⅰ中生成NaYO3的歧化反应的离子方程式为(用化学式表示): ____________。
④步骤Ⅱ中向NaYO3的溶液中加入粉末状的KY,搅拌后生成KYO3。已知有2L 3mol/L的NaYO3溶液,则至少需要加入__________mol KY粉末可将溶液中的YO3-离子沉淀至浓度变为0.1mol/L。(已知Ksp(KYO3)= 0.366,计算结果保留两位小数,加入KY粉末后溶液体积不变 )、
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。表1
| 酸或碱 |
电离平衡常数(Ka或 Kb) |
| CH3COOH |
1.8×10-5 |
| HNO2 |
4.6×10-4 |
| HCN |
5×10-10 |
| HClO |
3×10-8 |
| NH3·H2O |
1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是(填序号)。
| A.升高温度 | B.加水稀释 | C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(2)CH3COONH4的水溶液呈(选填“酸性”“中性”或“碱性”),理由是:
,
溶液中各离子浓度大小的关系是。
II.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)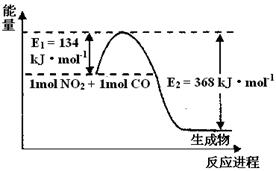
(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
①试比较K1、K2的大小,K1_K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是____(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)正=3v(H2)逆
c.容器内压强保持不变d.混合气体的密度保持不变
③在400℃时, 当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正__ v(N2)逆(填写“>”、“=”或“<”)