(18分)银是一种在工业、生活上有广泛用途的金属。
已知:①金属在水中存在如下溶解平衡过程:M  Mx+ + xe-,
Mx+ + xe-,
氢气在水溶液中也存在如下平衡过程:H2 2H+ + 2e-
2H+ + 2e-
②Ag2S 的Ksp=6.7×10-50; AgCl的Ksp=1.6×10-10
据此回答下列有关问题:
(1)银质餐具可杀菌消毒,原因是_________________(用适当的方程式和文字表述说明);金属银与氢硫酸可反应生成黑色固体和无色气体,写出该反应的化学方程式_______________
(2)金属银与硝酸银溶液组成电池示意图如右,a电极的反应为________________,NO3-从电池________侧溶液向电池_______侧溶液移动 (填“左”或“右”)。

(3)硝酸银见光或受热易分解为Ag、NO2、O2,反应中生成NO2、O2的 物质的量之比为___________,将混合气体通过水吸收后,剩余气体为________________
(4)已知:Ag+(aq) + 2NH3•H2O(aq)  [Ag(NH3)2]+ (aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
[Ag(NH3)2]+ (aq) + 2H2O K=1.6×107,写出AgCl溶于氨水的离子方程式________________________;计算该反应的平衡常数K=___________。在氯化银溶于氨水后的溶液中滴加稀硝酸,会再产生白色氯化银沉淀,滴加硝酸至刚好沉淀完全,取上层清液测其pH,发现呈酸性,主要原因是_______________(用离子方程式表示)。
I、在理论上不能用于设计原电池的化学反应是
| A.CH4(g)+2 O2(g)=" C" O2(g)+2 H2O(1) △H <0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(aq)+8H2O(1) △H >0 |
| C.4Al(s)+ 6H2O(1)+ 3O2(g)==4Al(OH)3(s) △H <0 |
| D.Zn(s)+2MnO2(s)+2H2O(1)= 2MnOOH(s)+Zn(OH)2(s) △H <0 |
若你认为A可以设计成原电池,创造碱性环境,请写出负极的电极反应式为 (若你认为不能此空不填)。
II、北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) = CH4(g)+HC CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH CH2(g) = CH4(g)+HC
CH2(g) = CH4(g)+HC CH(g )△H2=32.4 kJ·mol-1
CH(g )△H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH CH2(g)+H2(g)的△H= kJ·mol-1。
CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。负极的电极反应式为
填空:
(1)含0.4mol A13+的Al2(SO4)3中所含的SO42-的物质的量是_____________;
(2)已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为______________;
(3)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)____________________。
(4)在标准状况下,44.8L的NH3气体质量为 g, 其中含 个氢原子,其中含 molN, 将其溶于水配成200mL的溶液,其物质的量浓度为_ mol/L。
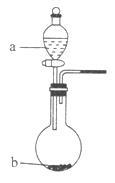
纳米级Cu2O是优良的催化剂和半导体材料,工业上常用下列方法制备Cu2O。
(1)热还原法:加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为________________________________。
(2)电解法:以氢氧燃料电池为电源,用电解法制备Cu2O装置如图所示。
①A的化学式为___________________________。
②燃料电池中,OH-的移动方向为______________(填“由左向右”或“由右向左”);电解池中,阳极的电极反应式为____________________________。
③电解一段时间后,欲使阴极室溶液恢复原来组成,应向其中补充一定量的_____________(填化学式)。
④制备过程中,可循环利用的物质为________________(填化学式)。
(3)干法还原法
利用反应Cu+CuO Cu2O也可制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为_________________。
Cu2O也可制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为_________________。
甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图: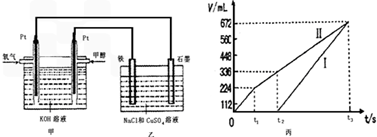
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
W、X、Y、Z四种短周期元素在周期表中的位置如图所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物。
请回答下列问题。
(1)H2Y2的电子式为______________________,Z在周期表中的位置___________________。
(2)在图中,b的pH约为7,且含有Fe2+和淀粉KI的水溶液,a为H2Y2的水溶液,旋开分液漏斗旋钮,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________。
(3)已知:298K时,金属钠与Y2气体反应,若生成1molNa2Y固体时,放出热量414kJ;若生成1molNa2Y2固体时,放出热量511kJ。则由Na2Y固体与Y2气体反应生成Na2Y2固体的热化学方程式为_____________。
(4)有人设想利用原电池原理以气体Z2和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解溶液,则通入Z2的电极为原电池的___________极,其电极反应式为____________________。