能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH。则H2与CO反应生成CH3OH的热化学方程式为: 。
(2)如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。 ①使用时,空气从 口通入(填“A”或“B”);
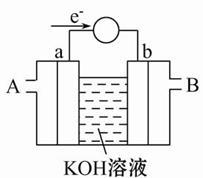
②假设使用的“燃料”是甲醇,a极的电极反应式为:
③假设使用的“燃料”是水煤气(成分为CO、H2)用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为 。
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子 两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管.
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
③向B溶液中滴入D溶液,无明显实验现象.请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________.
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为__________________.
(3)③中若是向C溶液中滴入D溶液,可能出现的实验现象是,
反应离子方程式为.
将7.1g Na2SO4放人足量水中完全溶解,得到200g Na2SO4溶液,则该溶液中含有溶质Na2S04的物质的量为_________mol,溶液中Na+的物质的量为________mol,SO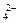 的物质的量为_________mol。此溶液中Na2SO4的质量分数为_________。
的物质的量为_________mol。此溶液中Na2SO4的质量分数为_________。
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式
(2)工业上制取漂白粉的化学方程式为____________________。漂白粉露置于空气中失效的原因是(用化学方程式表示):
①_________,
②___________________。
(1)新制备的氯水显__________色,说明氯水中有__________(填分子式)分子存在。
(2)向氯水中滴加几滴AgNO3溶液,立即有__________生成,说明氯水中有__________(填化学式)存在,反应的化学方程式为__________________________。
(3)氯水光照后颜色变浅,并放出________色的气体。
新切开的金属钠,切面呈________色,在空气中很快变暗,有关的化学方程式是________.将小块金属钠投入盛有水的烧杯里,钠熔化成闪亮的小球,说明________.向烧杯中滴加酚酞试液,溶液呈________色,说明________,反应的化学方程式为_____