研究氮、硫及卤素(F、Cl、Br、I)等单质及其化合物的反应在工农业生产、日常生活和环境保护中有重要意义。
(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,该反应的化学方程式为 。NH3的电子式为 。硝酸生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把一氧化氮还原成无色无毒气体,直接排入空气中,有关反应的化学方程式为 。
(2)已知在加热条件下浓硫酸能将木炭粉氧化,该反应的化学方程式为 。某学习小组设计实验来验证上述反应所产生的各种产物,将该反应生成的气体依次通过①装有无水硫酸铜的U型管 ②装有品红溶液的洗气瓶 ③装有酸性KMnO4溶液的洗气瓶 ④装有品红溶液的洗气瓶 ⑤装有澄清石灰水的烧杯,实验中能说明产物内含有CO2的现象是 。
(3)某学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。该小组设计的实验操作依次为:①向NaBr溶液中通入氯气 ②向KI溶液中通入氯气,若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是 (用离子方程式表示)。从原子结构的角度解释氯、溴、碘氧化性逐渐减弱的原因是 。
有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化: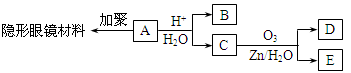
已知:Ⅰ.物质B是最简单的二元醇,已知两个羟基连在同一个碳上不稳定;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.
回答下列问题:
(1)隐形眼镜材料的结构简式为;
(2)写出物质B在铜催化下与O2反应的化学方程式;
(3)与C互为同分异构体,分子为链状的酯类物质共有种;
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。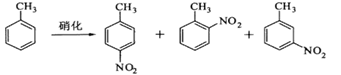
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是。
(2)滤液在分液漏斗中洗涤静置后,有机层处于层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |
n(催化剂) n(甲苯) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
| 对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
|||
| 浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
| 1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
| NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
| 0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
| 0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
| 0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有。
已知一氧化碳与水蒸气的反应为
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
在密闭容器中,将1.0mol CO与3.6mol H2O混合加热到434℃,在434℃的平衡常数K1=9,
(1)我们跟踪测定H2O的物质的量浓度,如图所示: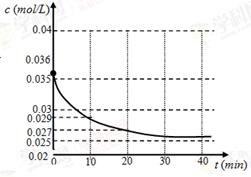
则0~20min的反应速率是________
(2)从434℃升温至800℃,800℃的平衡常数K2=1,则正反应为_____________(填“放热反应”或“吸热反应”或“不能确定”)。
(3)求800℃平衡时CO转化为CO2的转化率(写出必要的计算过程)。
在我校食堂南侧的绿树青草间,有一由井水形成的弯弯小溪。近来发现,昔日那碧波澄清的水面上,泛起了棕红色的“水锈”,小煞风景。
(1)根据学过的知识,你认为该“水锈”的主要成分可能是(写化学式)。
(2)怎样用化学方法检验此“水锈”的主要成分?简述实验操作:
第一步:取含“水锈”的混浊液少许于试管;
第二步:;
第三步:。
上述有关反应的离子方程式为、。
如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
(1)A极是电源的,甲装置观察到的现象是、、。
(2)C极的电极反应式为。
(3)现用丙装置给铜件镀银,则H应该是(填“镀层金属”或“镀件”),电镀液是
溶液。