一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:
CO2(g)+H2S(g)  COS(g)+H2O(g)
COS(g)+H2O(g)
| 容器 |
温度/K |
起始物质的量/mol |
平衡物质的量/mol |
平衡常数 |
|
| CO2 |
H2S |
H2O |
|||
| Ⅰ |
607 |
0.11 |
0.41 |
0.01 |
/ |
| Ⅱ |
607 |
0.22 |
0.82 |
/ |
|
| Ⅲ |
620 |
0.1 |
0.4 |
/ |
6.74×10-3 |
下列说法正确的是
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10-3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列关于该电池的叙述错误的是( )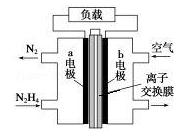
| A.b 极发生还原反应 | |
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+ |
C.放电时,电流从 b 极经过负载流向 a 极 |
| D.其中的离子交换膜需选用阴离子交换膜 |
将 0.1 L 含有 0.02mol CuSO4和 0.01molNaCl 的水溶液用惰性电极电解。电解一段时间后,一个电极上得到 0.01 mol Cu,另一电极析出的气体()
| A.只有Cl2 | B.既有Cl2又有O2 | C.只有O2 | D.只有H2 |
如图所示,甲池的总反应式为 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是()
| A.若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银 |
| B.甲池通入 CH3OH 的电极反应式为 CH3OH+6e﹣+2H2O═CO2-3+8H+ |
| C.反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4 溶液恢复到 原浓度 |
| D.甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体 |
已知常温下,KSP(AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17mol2·L-2,下列叙述中, 正确的是( )
| A.常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 |
| B.向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 |
| C.将 0.001 mol·L-1的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 |
| D.向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
右图装置中,U 型 管内为红墨水,a、b 试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )
| A.生铁块中的碳是原电池的正极 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中相同的电极反应式是:Fe-2e-="==" Fe2+ |
| D.a 试管中发生了吸氧腐蚀,b 试管中发生了析氢腐蚀 |