能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+H2SO3 |
| D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑ +H2O |
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有()
| A.3种 | B.4种 | C.5种 | D.6种 |
纯净物X、Y、Z转化关系如右图所示,下列判断正确的是()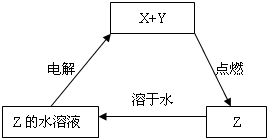
| A.X可能是金属铜 |
| B.Y不可能是氢气 |
| C.Z可能是氯化钠 |
| D.Z可能是三氧化硫 |
下列叙述不正确的是()
① 熔点:金刚石>晶体硅>单质硫
② 气态氢化物的稳定性:H2O>HF>H2S
③ 同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
④ 因为常温下白磷可自燃,而氮气需要在放电时才与氧气反应,所以非金属性:P>N
⑤ 碱性氧化物一定是金属氧化物
| A.①②③ | B.②③④ | C.②④⑤ | D.①③⑤ |
同温同压下,相同质量的SO2(气体)和SO3(气体)相比较,下列有关叙述正确是① 它们所含分子数目之比为4:5;② 它们所含氧原子数目之比为5:6;③ 它们所含原子总数之比为1:1;④ 它们所含的硫原子数目之比为5:4;⑤ 它们的密度之比为4:5
| A.②③⑤ | B.①④⑤ | C.②④⑤ | D.①②⑤ |
某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是()
| A.一定存在HCl | B.一定存在SO2 | C.肯定没有CO2 | D.不能肯定是否含有HI |