太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
回答下列问題:
(1)二价铜离子的电子排布式为 .已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释
(2)(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为_________.类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 .
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 .
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 .六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3.(只要求列算式).
(5)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。

(12分)A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:
(1)E的电子式是。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是。
(已知甲醇的燃烧热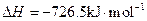 ,氢气的燃烧热
,氢气的燃烧热 )
)
[选修—有机化学基础]
有机物A、H、O分子式相同,经测定相对分子质量不超过110。分子中只含C、H、O三种元素,碳的百分含量为60%,其中A能发生银镜反应。A的碳链无支链;B分子中只有五元环。有关的转化关系如图24的示。请回答下列问题:
(1)写出B的结构简式;1分子核磁共振氢谱中有3种峰,其峰面积之比为1:2:1,I的名称是。
(2)写出C—E反应类型是;F—G的反应类型是。
(3)写出D—C、G—H的化学反应方程式。
D—C;
G—H。
(4)写出与B属地同分异构体,分子中有一个五元环且能与银氨溶液反应的结构简式
。
[选修—物质结构与性质]
羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中素。请回答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式。
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为杂化。与CO分子互为等电子体的分子和离子各写出1种,分别为和(填化学式),CO分子的结构式可表示为。
(3)Fe(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体为。
(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl的晶体结构相似(如23所示)①比较晶体熔点的高低MgOCaO(填“高于”或“低于”)
②若在FeO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3。则阿伏伽德罗常数NA表达式为mol-1。
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池,除氢气外,烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池.写出其正极反应式
。
(2)以上述电池为电源,通过导线与图14电解池相连。
(Ⅰ)X、Y为石墨,a为1L0.1mol/L的氯化钾溶液,写出电解总反应的离子方程式
。
(II)X、Y分别为铁、铜,a为1L0.1mol/L硫酸铜溶液,写出X电极反应式
。
(3)室温时,按(I)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图15(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①结合图15计算消耗标准状况下甲烷mL。
②若图15的B点pH=7,则酸碱恰好完全反应的点是区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系是。
下列框图中涉及的物质是中学化学常见的。其相互转化关系如图13所示。已知:单质A在单质G中能燃烧,其产物溶于水得 L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
(1)写出B、L的名称:B、L;写出F在工业上的任何两点用途。
(2)写出③的化学方程式。
(3)说出形成单质C的元素在元素周期表的位置,第周期,第族。
(4)将E通入到某种棕黄色的溶液中也有L、F生成。其反应的离子方程式为
。
(5)写出④反应的化学方程式。