(1)已知1g碳粉在氧气中完全燃烧放出的热量是32.8 kJ,试写出表示碳燃烧热的热化学方程式
(2)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
①合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“正向”、“逆向”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“正向”、“逆向”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”)。
②已知:O2(g)  O2+(g)+e- △H1=+1175.7 kJ·mol—1
O2+(g)+e- △H1=+1175.7 kJ·mol—1
PtF6(g)+e- PtF6-(g) △H2=-771.1 kJ·mol—1
PtF6-(g) △H2=-771.1 kJ·mol—1
O2PtF6(s) O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol—1
O2+(g)+PtF6-(g) △H3=+482.2 kJ·mol—1
则反应O2(g)+PtF6(g)  O2PtF6 (s)的 △H=_____________
O2PtF6 (s)的 △H=_____________
(1)、相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:
(2)、将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)、写出Na2CO3溶于水后的电离方程式: __________________________________________________________________
(4)、写出氯化铁溶液水解反应的离子方程式,并判断溶液的酸碱性:_____________________________________________________________溶液显________性
(1)下列操作使结果偏高(或增大)的是 .
①用稀NaOH溶液与稀盐酸反应测定反应热,用铁质搅拌器
②中和滴定的锥形瓶用蒸馏水洗后,未用待测液洗
③用0.1mol·L-1的NaOH溶液滴定未知浓度的盐酸,碱式滴定管未用标准液润洗
④用蒸馏水湿润的pH试纸测定0.1mol·L-1的醋酸溶液的pH
(2)在纯碱溶液中滴入酚酞,溶液变红。原因是 (用离子方程式表示)若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ,其原因是(以离子方程式和简要文字说明): 。
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)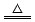 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中__________(填写化学式,下同) 失去电子,氧化剂是____________。
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为_________L (假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:___________________
计算反应后所得沉淀的质量为__________________g(保留到0.1g)。
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,消毒杀菌能力更强,且无二次污染;工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4+6Na2O2 ="=" 2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中的氧化剂是,还原剂是,每生成1mo1Na2FeO4转移电子的数目为
②简要说明K2FeO4,作为水处理剂时,在水处理过程中所起的作用(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1 mo1 FeO42-转移mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明。
中学化学中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡4种,且均符合平衡移动原理。请回答下列问题:
(1)现将4 mol SO2和2 mol O2充入固定容积为2 L的密闭容器中,500 ℃进行反应并保持温度不变,反应达到平衡。若在温度不变的条件下,再向平衡体系中加入2 mol SO2、2 mol O2与4 mol SO3,平衡将向________移动。
(2)常温下,取pH=2的盐酸和醋酸各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1,醋酸中加入的Zn粒质量为m2。则m1________m2(填“<”、“=”或“>”)。
(3)难溶电解质在水溶液中存在溶解平衡。在常温下,溶液中各离子浓度以它们化学计量数为指数的乘积是一个常数,叫溶度积常数(Ksp)。当溶液中各离子浓度指数的乘积大于溶度积时,则产生沉淀,反之固体溶解。若某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于________(已知Ksp=2.0×10-20)。
(4)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈________性。在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO32-水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论):_________________。