实验室常用加热氯酸钾和二氧化锰混合物的方法制取氧气,写出反应的文字或符号表达式: 。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
【完成实验】按下表进行分析:测定分解温度(分解温度越低,催化效果越好)。
| 实验编号 |
实验药品 |
分解温度(℃) |
| ① |
氯酸钾 |
580 |
| ② |
氯酸钾、二氧化锰(质量比1:1) |
未测 |
| ③ |
氯酸钾、氧化铜(质量比l:1) |
370 |
| ④ |
氯酸钾、氧化铁(质量比1:1) |
390 |
【分析数据、得出结论】
(1)由实验_____________与实验④对比,证明猜想合理。
(2)已知实验所用的三种物质中,催化效果最好的是二氧化锰,则实验②的分解温度 370(填“>”、“=”或“<”)。
【反思】
(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后质量和 不变;
(2)已知氯酸钾的熔点为356℃,结合上表数据,你认为加热氯酸钾和氧化铁的混合物制氧气最适宜的装置是 (填字母)

(3)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证
天然气作为燃料已进入千家万户,其主要成分是CH4,它在空气中完全燃烧生成CO2和H2O。如果它不完全燃烧会生成什么物质呢?某研究小组对此展开探究。
请写出CH4完全燃烧的化学方程式 ____________________________,
[猜想]由此推测生成物中一定有H2O,可能有的气体 ①CO2②CO③CO2 CO
[实验探究]该小组将生成的混合气体依次通过下图所示装置,验证猜想。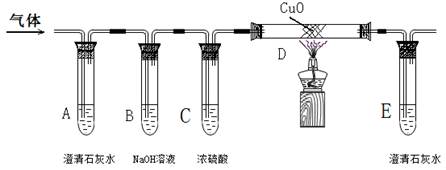
(1)若猜想③成立,则该实验中有__________________________________________的现象。
(2)若混合气中有CO,D中发生的化学方程式为___________________________________.
(3)小文提出:从环保角度看,此装置有一个不足之处,你认为是______________________.
某校化学实验兴趣小组想了解水的组成,他们做了如下实验:(13分)
【提出疑问】水是由什么元素组成的?
【作出猜想】猜想(1)水是由氧元素组成;猜想(2)水是由氢元素组成;
猜想(3)水是由氢元素和氧元素组成。
【设计实验】[实验]如下图:电解水的实验
【实验现象】
①通电后,两根电极上都出现。
②一段时间后正负两极试管内收集的气体体积比为;
③正极产生的气体是,负极产生的气体是。
【实验验证】本实验中生成的两种气体,你能鉴别吗?试说说:。
【实验结论】①水是由组成的。② 电解水的文字表达式。
【实验反思】通过本实验再次说明了在化学变化中是可分的;反应前后的种类是不变的。
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:;猜想三:Ca(OH)2。
他的依据是。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:
。
【进行实验】(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液,通入,有白色浑浊出现,证明猜想三成立。该反应的化学方程式为:。
结论:白色固体是Ca(OH)2。
【拓展应用】某市一辆满载电石的货车遇大雨引发熊熊大火,其中的可燃物是________,且该反应放出大量热,使可燃物达到_______________。
【交流反思】通过上述实验可知,电石在保存和运输时的注意事项_ ___
早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空:
(1)写出CO还原Fe2O3的化学方程式_____________________________。
(2)实验中盛澄清石灰水的试管中可观察到的现象是__________________。
(3)右边导气管口放置点燃的酒精灯的目的是__________________________。
(4)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是__________________________________。
探究性学习小组的同学发现化学实验室一瓶块状固体已失去标签。科代表将固体取少量于试管中,加入足量的稀盐酸,有大量的气泡冒出,经检验气体密度大于空气,用向上排空气法收集到一集气瓶气体。同学们很兴奋,该固体可能是什么物质?他们设计实验方案,展开探究。
(1)猜想:产生的气体可能是___________。
(2)检验气体的实验记录如下:
| 实验操作 |
实验现象 |
结论 |
产生的气体是__________。 |
(3)根据上述实验结果推断,块状固体可能是____________________。
(4)实验室制取该气体的化学反应方程式是:。