用右图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是
| A.向亚硫酸钠溶液中通入氯气 |
| B.向硝酸银溶液中通入少量氯化氢 |
| C.向氢碘酸饱和溶液中通入少量氧气 |
| D.向氢氧化钠溶液中通入少量氯气 |
在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
| A.正极发生得电子的氧化反应 | B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
下列含有非极性键的化合物是:
| A.MgCl2 | B.Na2O2 | C.H2O | D.N2 |
下列元素中,原子半径最大的是
| A.Li | B.Na | C.F | D.Cl |
下列措施不符合节能减排的是
| A.大力发展火力发电,解决电力紧张问题 |
| B.在屋顶安装太阳能热水器为居民提供生活用热水 |
| C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 |
| D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 |
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )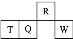
| A.最简单气态氢化物的热稳定性:R>Q | B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R | D.含T的盐溶液一定显酸性 |