三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
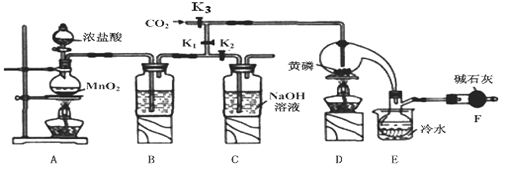
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和气体;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请回答下列问题:
(1)B中所装试剂是 ;
E中冷水的作用是 。
(2)F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为 。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为 。
用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。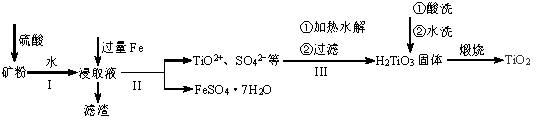
回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
| A.TiOSO4中钛元素的化合价为+4价 |
| B.TiO2中既含有离子键,又含有共价键 |
| C.钛元素位于元素周期表中IVA族 |
| D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为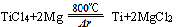
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________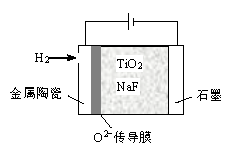
某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验。
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,
过滤、冷水洗涤、低温干燥,得到蓝绿色固体。该小组同学猜想此固体为xCuCO3·yCu(OH)2。
(1)为了验证猜想,先进行定性实验。
(2)为进一步确定蓝绿色固体的组成,使用如下装置再进行定量实验。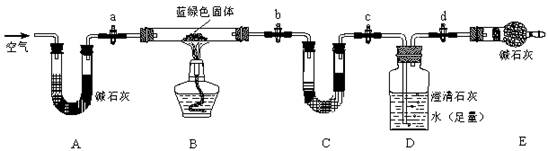
实验Ⅲ:称取5.190g样品,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置C和D中。
①装置C中盛放的试剂是________________,装置E的作用是____________________,反应结束时要通入适量的空气,其作用是____________________________________。
②实验结束后,测得装置C增重0.270g,装置D增重1.320g。则该蓝绿色固体的化学式为____________。
(3)若x=y=1,写出CuSO4溶液与Na2CO3溶液混合时反应的化学方程式______________。
(4)已知20℃时溶解度数据:S[Ca(OH)2] =" 0.16" g,S[Ba(OH)2] =" 3.89" g。有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液,其可能的依据之一是_________________________。
(5)有同学为了降低实验误差,提出如下建议,其中合理的是______(填字母序号)。
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置
(11分)三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵( ),其反应化学方程式:2NH3(g)+CO2(g)
),其反应化学方程式:2NH3(g)+CO2(g)  NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取CO2,该实验利用干冰升华产生气体CO2的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素[CO(NH2)2] _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
在实验室里可用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
上图中:①为氯气发生装置;②的试管里盛有15 mL 30%KOH溶液,并置于水浴中;③的试管里盛有15 mL 8%NaOH溶液,并置于冰水浴中;④的试管里盛有紫色石蕊溶液。
请回答下列问题:
(1)仪器a的名称是_________________。
(2)实验室制取氯气的离子方程式为___________________________________________。
为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_____填字母代号)的净化装置。
| A.碱石灰 | B.饱和食盐水 |
| C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是________________________。反应完毕经冷却后,②的试管中有大量晶体析出。在图中符合该晶体溶解度曲线的是_____填字母代号);从②的试管中分离出晶体的操作是________,该操作需要用到的玻璃仪器有____________________________。
(4)次氯酸钠中存在的化学键类型为_______________________________。
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请完成下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_________色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
_________________________________________ |
| 然后溶液从无色逐渐变为_________色 |
_________________________________________ |
(6)装置⑤的作用是___________________________。
(18分)Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是______(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2②NO ③Cl2 ④H2⑤HCl
其中在D装置中连接小烧杯的目的是。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(4)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3 ,钴的化合价为________,制备X的化学方程式为。
已知:X的化学式类似下列化学式
氢氧化二氨合银:Ag(NH3)2OH 、硫酸四氨合铜:Cu(NH3)4SO4
(5)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1 的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
①盛放5(盐酸标准溶液)的仪器名称。
②装置中安全管的作用原理是。
③样品中氨的质量分数表达式为。