白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P 4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为_______________。
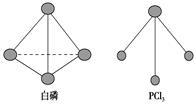
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能:P—P 198 kJ·mol-1,Cl—Cl 243 kJ·mol-1,P—Cl 331 kJ·mol-1。则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
烷基取代苯 可以被酸性KMnO4溶液氧化,生成
可以被酸性KMnO4溶液氧化,生成 ,但若烷基R中直接与苯环相连的碳原子上没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环相连的碳原子上没有C—H键,则不容易被氧化得到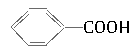 。现有分子式为C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式为C11H16的一烷基取代苯,已知它可以被氧化成为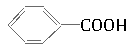 的异构体有7种,其中3种是
的异构体有7种,其中3种是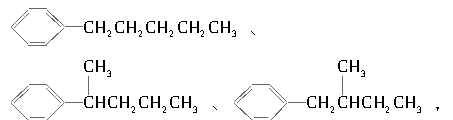 ,
,
请写出其他4种的结构简式:
________________________________________________________________________,
________________________________________________________________________,
________________________________________________________________________,
________________________________________________________________________。
下图中每一方框的字母代表一种反应物或生成物:
已知气态烃D(其密度在同温同压下是氢气密度的13倍)跟物质F反应时产生明亮而带浓烈黑烟的火焰。请写出下列字母代表的物质的化学式:
A、B、D、E、H。
已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如图所示:
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D,转化过程如下图所示。请回答相关相关问题:
(1)CH3COOOH称为过氧乙酸,写出它的一种用途。
(2)写出B+E→CH3COOOH+H2O的化学方程式。
(3)写出F可能的结构简式。
(4)写出A的结构简式。
(5)1摩尔C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比是。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:
。
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验。通过SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:____________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?_______________________________________________。
请简要说明两点理由:①_____________________________;② __________________。