下列关于钠的说法不正确的是
| A.金属钠与O2反应,条件不同,产物不同 |
| B.钠—钾合金通常状况下呈液态,可作原子反应堆的导热剂 |
| C.钠的化学活泼性很强,少量的钠可保存在煤油中 |
| D.将金属钠投入水中,生成氢氧化钠,同时放出O2 |
汽车尾气中,产生NO的反应为:N2(g)+O2(g)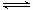 2NO(g),一定条件下,等物质的量的N2(g)和O2(g).在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g).在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是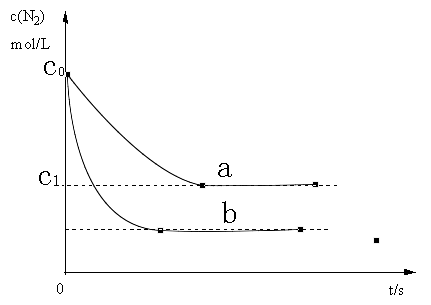
A.温度T下,该反应的平衡常数K= |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=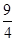 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
B.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
C.平衡时,乙中CO2的转化率大于60%
D.平衡时,甲中和丙中H2的转化率均是60%
温度一定时,在密闭容器中发生可逆反应:mA(S)+nB(g) pC(g),达到平衡后,若将混合气体的体积压缩到原来的
pC(g),达到平衡后,若将混合气体的体积压缩到原来的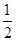 ,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是
,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是
| A.平衡向逆反应方向移动 |
| B.C气体的体积分数增大 |
| C.气体A的转化率升高 |
| D.m+n<p |
对于可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列叙述正确的是
2SO3(g) ΔH<0,下列叙述正确的是
| A.单位时间内生成2molSO3的同时消耗了1molO2,则反应到达平衡状态 |
| B.升高温度反应速率增大,由于该反应是放热反应,V(逆)小于V(正),所以反应达到平衡的时间将延长 |
| C.保持温度和密闭体系体积不变,起始加入2molSO2和1molO2,平衡后加入2molSO2和1molO2,重到达平衡时SO2的体积分数减小 |
D.该反应的化学平衡常数表达式为 |
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成nmolCO的同时生成nmolH2 |
| D.1molH—H键断裂的同时断裂2molH—O键 |