火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为______________。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应热△H3___________0(填“>”、“<”或“=”),该反应的平衡常数表达式为_____________。
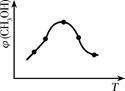
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示。
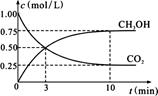
试回答:0~10 min内,氢气的平均反应速率为______________mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数___________(填“变大”、“减少”或“不变”)。
(3)脱硫。
①有学者想利用如右图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。
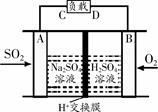
则电子流出的电极为_____________(用A或B表示),A极的电极反应式为_____________。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为__________;常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,则溶液的pH 7(填写“>”“=”或“<”)。
已知元素的电负性和原子半径一样,也是元素的一种基本性质,下面给出14种元素的电负性:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| 电负性 |
1.61 |
2.04 |
1.57 |
2.55 |
3.16 |
3.98 |
0.98 |
| 元素 |
Mg |
N |
Na |
O |
P |
S |
Si |
| 电负性 |
1.31 |
3.04 |
0.93 |
3.44 |
2.19 |
2.58 |
1.90 |
(1)根据上表给出数据,可推知元素的电负性具有的变化规律是____________________
(2)预测Br与I元素电负性的大小关系是__________________,电负性最小的元素在周期表中的位置是________________________。(放射性元素除外)
(3)离子化合物和共价化合物之间没有绝对的界限,习惯上把SrI2看作离子化合物,把BaS看作共价化合物。(电负性:Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用△X表示,请找出用△X来判断离子键或共价键的数值范围:
即当△X___________时一般为共价键,当△X___________时一般为离子键。试判断AlBr3中化学键的类型是__________。
已知五种元素为短周期元素,其原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称A________,B________,C________,D________,E________;
(2)用电子式表示A2C的形成过程________________________________;
(3)D与E形成常见离子的空间构型为________________;
(4)A、B两元素形成的化合物A2B2属于__________晶体(填类型),晶体内存在的化
学键有___________;A2B晶体的熔点_______(填“>”“=”“<”)A2C晶体的熔点;
(5)由A、B、C、E四种元素,可以共同形成两种不同化合物,它们的水溶液可以反应
生成一种气体,请写出离子方程式:___________________________________。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 |
X |
Y |
|
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7296 |
4570 |
1820 |
| 失去第三个电子 |
11799 |
6920 |
2750 |
| 失去第四个电子 |
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。。
②表中X可能为以上13种元素中的(填写字母)元素。用元素符号表示X和j形成化合物的化学式。
③Y是周期表中族元素。
④以上13种元素中,(填写字母)元素原子失去核外第一个电子需要的能量最多。
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后
溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表 示);
示);
(2)混合溶液中由水电离出的c(H+)_____0.1 mol·L-1 NaOH溶液中由水电离出
的c(H+);(填>、<、=)
(3)求出混合液中下列 算式的精确计算结果(填具体数字):
算式的精确计算结果(填具体数字):
c (Na+)-c (A-)="________" mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断
(NH4)2CO3溶液的pH_______7 (填>、<、=);
无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、
Cl-、OH-、HCO3-、NO3-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。
试回答:
(1)若溶液和铝反应后有AlO2-生成,则其中一定含有大量的__________离子,
还可能含有大量的_________________离子。
(2)若溶液和铝反应有Al3+生成,则原溶液中一定不含有大量的__________离子。