请用单线桥或双线桥表示出以下反应电子的转移情况:
2KMnO4 + 16HCl = 2KCl+ 2MnCl 2+ 5Cl2↑+ 8H2O,
当3.16 g KMnO4与50mL 12 mol·L-1过量浓盐酸完全反应(假设浓盐酸无挥发),通过计算回答:(1)反应中被氧化的HCl的物质的量为 ;转移了 个电子。
(2)产生的Cl2在标准状况下的体积为多少升?
(3)在反应后的溶液中加足量的AgNO3溶液可生成多少克沉淀?
利用“化学计量在实验中的应用”的相关知识进行填空
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_________
(2)将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为_______。
(3)将50 mL 0.1 mol·L-1 NaCl和50 mL 0.5 mol·L-1 CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c (Cl-)为______________。
实验室用20 g软锰矿(主要成分MnO2)与200 mL 12 mol/L的浓盐酸(足量)反应,制得标准状况下4.48L Cl2。过滤反应后的混合物得滤液,向滤液中加入足量的硝酸银溶液,产生白色沉淀。若浓盐酸的挥发忽略不计,试计算:
(1)软锰矿中MnO2的质量分数是多少?
(2)反应中被氧化的HCl物质的量为多少?
(3)滤液中加入足量硝酸银后产生的白色沉淀的质量是多少?
一定量的液态化合物XY2,在一定量O2中恰好完全反应:
XY2(液)+ 3O2(气)= XO2(气)+ 2YO2(气)
冷却后在标准状况下,测得生成物的体积为672mL,密度为2.56g/L。则:
(1)反应前O2在标准状况下的体积是mL;
(2)化合物XY2的摩尔质量是。
铜与浓硝酸反应的化学方程式如下:Cu +4HNO3(浓)==Cu(NO3)2+2 NO2↑+2H2O将 3.2 g铜完全溶于足量的 50 mL 11.0 mol•L-1的浓硝酸中,只生成NO2气体,假设反应后溶液的体积仍为 50 mL。试计算
(1)反应后可生成标准状况下NO2气体多少 L? (写计算过程)
(2)反应后溶液中NO3-物质的量浓度为_________________________。
取NaHCO3和Na2O2的固体混合物x g放入一密闭容器中加热至250℃,充分反应后排出所有气体。将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀。另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如下图所示。试回答下列问题: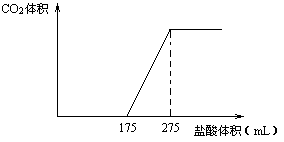
(1)加入盐酸后总共产生的气体在标准状况下的体积为__________________L;
(2)盐酸中HCl的物质的量浓度__________________;
(3)反应后的固体的成分(填化学式)__________________;
(4)密闭容器中排出气体的成分(填化学式)______________;
(5)x=_____________。