亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。

已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl ="=" 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液。配制过程如下图所示:
请根据题意回答:
(1)配制该溶液应选用(填仪器)。
(2)用______(填滤纸或小烧杯)在托盘天平上称取_____ NaOH固体。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应。
(4)配制好的溶液(填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是
| A.容量瓶中原来有少量蒸馏水 | B.定容时观察液面俯视 |
| C.忘记洗涤 | D.定容时观察液面仰视 |
海藻中含有丰富的碘元素,碘元素通常以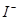 的形式存在。实验室从海藻灼烧后的海藻灰中提取
的形式存在。实验室从海藻灼烧后的海藻灰中提取 的流程如图所示:
的流程如图所示: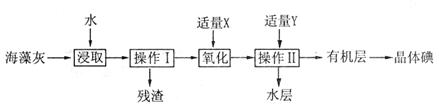
(1)操作I是__________,操作II是__________。
(2)试剂X可以选择__________。
A. 氯气 B. 氢氧化钠 C. 过氧化氢 D. 稀硫酸
(3)试剂Y可以选择__________。
A. 酒精 B. 四氯化碳 C. 醋酸 D. 苯
(4)该实验中为使海藻灰中I-转化为I2的有机溶液,除烧杯、普通漏斗和必要的夹持仪器外,还需要的玻璃仪器有__________、__________。
(5)操作II完成后,判断水层中是否残留I2的实验方法是__________。
某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据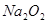 和
和 的反应,用类比的方法推理
的反应,用类比的方法推理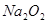 与
与 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据 的强还原性和
的强还原性和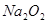 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有 。为检验生成物中是否存在
。为检验生成物中是否存在 ,他们设计了如下实验方案:
,他们设计了如下实验方案:
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向 溶液中缓慢通入
溶液中缓慢通入 气体,请分析通入
气体,请分析通入 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。
 的范围 的范围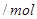 |
溶液中溶质的化学式 |
| (0,0.5) |
__________ |
| __________ |
 、 、 |
请在下图中画出溶液中溶质的总质量随缓慢通入 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质(不与盐酸反应)的样品,配成500 mL待测溶液。称量时,样品可放在(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视;
在铁架台上垫一张白纸,其目的是。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是mol·L-1,烧碱样品的纯度是。
| 滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(每空1分,共7分)某兴趣小组用石灰石和稀盐酸反应制取CO2,并验证CO2的性质。在确认装置气密行良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)[提出问题]澄清石灰水为什么水没有变浑浊?
[猜想与验证]①甲同学认为可能澄清石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是:_____,说明澄清石灰水没有变质。
②乙同学认为制得的CO2中可能有HCl气体。他作出此猜想的依据是_____________________,他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有气体。
③丙同学认为乙同学的实验结论是错误的,理由是_________________________,请你帮助他们设计实验证明:
[实验验证]
| 实验步骤 |
实验现象 |
实验结论 |
| CO2中混有HCl气体 |
(2)反思与评价丁同学认为既然用稀盐酸制得的CO2不纯,为何不用H2SO4代替盐酸。请问丁同学的想法对吗?________;理由是_________________________________________。