下列有关设计的方案能达到实验目的的是
| A.制备Fe(OH)3胶体:向0.1mol·L-1FeCl3溶液中加入等体积0.3mol·L-1NaOH溶液 |
| B.除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉,充分反应后过滤 |
| C.比较Fe(OH)3和Al(OH)3的溶度积:向0.1mol·L-1FeCl3溶液中滴加0.1 mol·L-1 氨水至不再产生沉淀,然后再滴入0.1mol·L-1AlCl3溶液,观察现象 |
| D.验证氧化性Fe3+<Br2<Cl2:向试管中依次加入1mL 0.1mol·L-1FeBr2溶液、几滴KSCN溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机相和水相中的现象 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是()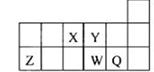
| A.原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
| B.离子Y2-和Z 3+的核外电子数和电子层数都不相同 |
| C.元素W与Q的最高价氧化物对应的水化物的酸性W的强 |
| D.元素X与元素Z的最高正化合价之和的数值等于8 |
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 |
甲 |
乙 |
丙 |
丁 |
| 原子半径/nm |
0.186 |
0.102 |
0.152 |
0.074 |
| 主要化合价 |
+1 |
+6、-2 |
+1 |
-2 |
下列叙述不正确的是()
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其熔融盐的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半径最大的
将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是()
A.a =3.36时,CO2+2OH- = CO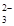 +H2O +H2O |
B.a =4.48时,2CO2+3OH- =CO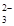 +HCO +HCO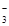 +H2O +H2O |
C.a =6.72时,CO2+OH- =HCO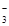 |
D.a =8.96时,3CO2+4OH- = CO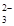 +2HCO +2HCO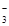 +H2O +H2O |
下列离子方程式正确的是()
| A.硫酸铜溶液与氢氧化钡溶液反应:SO42—+Ba2+===BaSO4↓ |
| B.将大理石投入到足量盐酸中:CO32—+2H+===CO2↑+H2O |
| C.将Cl2通入KI溶液中:2I-+Cl2===2Cl-+I2 |
| D.碳酸钠溶液显碱性:CO32—+H2O===HCO3—+OH- |
NA为阿伏加德罗常数,下列叙述正确的是()
| A.16 g氧气和16 g臭氧所含的原子数均为NA |
| B.常温常压下,11.2L氯气所含的原子数目为NA |
| C.2.3g钠由原子变成离子,失去的电子数为1.1NA |
| D.28g N2中所含的质子数目为7NA |