在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
3.48 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
1.58 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 。
(3)配制上述“鲜花保鲜剂” 用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 , (填写所缺仪器的名称)。
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容,
正确的操作顺序是 (填序号)。
(5)若定容时俯视容量瓶刻度线,会使所配溶液浓度 (填偏大、偏小、不变)。
合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
已知:① R—CH2—CH=CH2 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是,E中的官能团的名称是。
(2)写出A→B的反应方程式,该反应类型是。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出
E+H→I的反应方程式,该反应类型是。
(4)关于G的说法中错误的是(填序号)。
| A.1 mol G最多可与2 mol NaHCO3反应 |
| B.G可发生消去反应 |
| C.1 mol G最多可与2 mol H2发生加成反应 |
| D.1 mol G在一定条件下可与2 mol乙醇发生取代反应 |
含苯酚的工业废水的方案如下图所示:
回答下列问题:
(1)设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是。
(2)由设备②进入设备③的物质A是,由设备③进入设备④的物质B是。
(3)在设备③中发生反应的化学方程式为。
(4)在设备④中,物质B的水溶液和CaO反应,产物是、和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、、。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是。
①核磁共振氢谱只有一个峰②分子中无碳碳双键
在有机物分子中,不同氢原子的核磁共振谱中给出的信号也不同,根据信号可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为: CH3—CH2—O—CH2—CH3,其核磁共振谱中给出的信号有两个,如图①所示:
(1)下列物质中,其核磁共振氢谱中给出的信号只有一个的是。(填序号)
| A.CH3CH3 | B.CH3COOH | C. CH3OH | D. CH3OCH3 |
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图②所示,则A的结构简式为,请预测B的核磁共振氢谱上有种信号。
(3)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为;该烃在光照下生成的一氯代物在核磁共振谱中可产生种信号,强度比为。
(4)在常温下测定相对分子质量为128的某链烃的核磁共振谱,观察到两种类型的H原子给出的信号,其强度之比为9:1,则该烃的结构简式为,其名称为。
药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4-环己二酮单乙二醇缩酮)为原料合成(如下图)。
试填空:
(1)X的分子式为;该分子中最多共面的碳原子数为。
(2)Y中含有个手性碳原子。
(3)Z能发生反应。(填序号)
A.取代反应 B.消去反应C.加成反应 D.催化氧化反应
(4)鉴别X和Z可用下列何种物质?
A.Br2水B.酸性KMnO4溶液C.FeCl3溶液 D.Na2CO3溶液
(5)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠mol;
1 mol Z在一定条件下与足量Br2充分反应,需要消耗Br2 mol。
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 mol。
按要求填空:
(1)某有机物的结构简式为: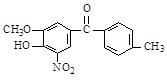 ,该有机物中含氧官能团有:、、、(写官能团名称)。
,该有机物中含氧官能团有:、、、(写官能团名称)。
(2)有机物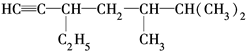 的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
(3)下图是某一有机物的红外光谱图,该有机物的相对分子质量为74,则其结构简式为。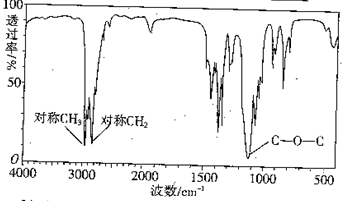
(4)苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下: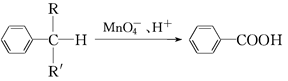
(R、R′表示烷基或氢原子)
①现有苯的同系物甲和乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是;乙能被酸性高锰酸钾溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有种。
②有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种。丙的结构简式共有四种,写出其余三种: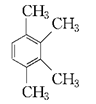 、、、。
、、、。
(5)已知:RCH=CHR,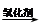 RCOOH+R,COOH。写出
RCOOH+R,COOH。写出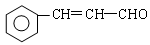 在强氧化剂条件下生成
在强氧化剂条件下生成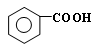 和另一种有机物(写出其结构简式)。
和另一种有机物(写出其结构简式)。