滴定实验是中学常用的定量实验,主要原理是利用已知浓度的某溶液滴加到未知浓度的溶液中,通过恰好完全反应的“终点”的判断,实验测出消耗的两种物质的量来计算未知浓度的溶液的浓度。
下面是甲同学用滴定实验来测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
A.准确称取w g食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
(1)配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)判断c中反应恰好完全依据的现象是:当滴加最后一滴Na2S2O3溶液后,溶液由 色变为 色,且颜色半分钟内不改变 。
(3)根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
(4)已知在酸性环境下:2H+ + S2O32- =" S↓" + SO2 ↑+ H2O,所以乙同学认为在c操作前应 ,否则实验测得食盐中碘的含量会 (填“偏高”或“偏低”或“没有影响”)
(10分)下图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用)。请根据下列要求回答问题。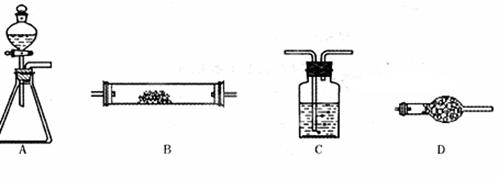
(1)若用A-C-D-B组合进行氢气还原氧化铜实验。分液漏斗中的试剂是盐酸,C中试剂是水,其作用是;A中反应开始一段时间后,再加热B。加热B之前的实验操作是。
(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A-C-B-D连接成实验装置体系。A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是(填名称);C中试剂是(填名称)。已知高锰酸钾反应生成+2价的锰离子,写出此法制备氯气的离子方程式。
(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是;(填字母)装置B中发生反应的化学方程式为。
6分)制备Cl2需用8 mol•L-1的盐酸100mL,现用12 mol•L-1的盐酸来配制。
①需要12 mol•L-1的盐酸的体积为mL(精确到0.1 mL)
②为完成配制,除玻璃棒,小烧杯外,还需要选择的仪器为。
A 100mL量筒 B托盘天平 C 100mL容量瓶 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
③ 在容量瓶的使用方法中,下列操作中,不正确的是(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近刻度线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
【化学——选修2:化学与技术】硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
已知几种盐的溶解度随温度变化的曲线如图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是______________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:__________________。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液______________。
甲、乙两同学欲分别完成“钠与氯气反应”的实验.
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I).该方案的不足之处有:
_______________________________(至少答出两点).
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 _________________________________ ;待装置中出现_____________现象后,点燃酒精灯.
(2)点燃酒精灯后,玻璃管中出现的现象是_______________________________(至少答出两点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积.
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是______(填“酸式”或“碱式”)滴定管.
②为提高测量的准确性,图Ⅲ装置中的液体可用______________;收集完气体并冷却至室温后读数,读数前应进行的操作是_______________.
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积______(填“偏大”、“偏小”或“无影响”).
对铜与浓硫酸反应的实验进行如下改正,根据下图所示实验回答下列问题: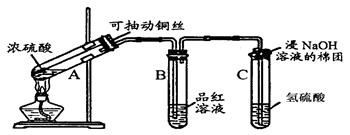
(1)试管C口部的棉团上发生反应的离子方程式是。
(2)试管C中溶液变浑浊,反应的化学方程式为。
(3)若将试管B中的溶液换成酸性KMnO4溶液,酸性KMnO4溶液紫红色会褪去,则反应的离子方程式为是。
(4)能使品红溶液褪色的物质有很多,如何证明使品红溶液褪色的是SO2而不是其它物质:?