有以下几种物质:①食盐晶体 ②铜 ③KNO3溶液 ④熔融的氢氧化钾 ⑤液态氯化氢。回答以下问题(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;
(2)以上物质中能导电且属于电解质的是 ;
已知:2NO(g)+2CO(g)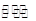 N2(g)+2CO2(g)
N2(g)+2CO2(g) 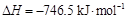 。请回答下列问题:
。请回答下列问题:
(1)对于气相反应,用某组分B的平衡分压p(B)代替平衡时物质B的物质的量浓度c(B)也可表示平衡常数,记作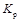 ,则该反应的平衡常数
,则该反应的平衡常数 。
。
(2)一定温度下,向密闭容器中充入一定量NO和CO。在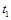 时刻达到平衡状态,此时
时刻达到平衡状态,此时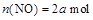 ,
,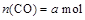 ,
, 。
。
①若保持体积不变,再向容器中充入a mol NO,2b mol CO2,则此时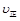
 (填“>”、“=”或“<”);
(填“>”、“=”或“<”);
②在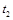 时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,
时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,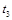 时刻达到新的平衡状态。请在下图甲中补充画出
时刻达到新的平衡状态。请在下图甲中补充画出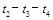 时段N2物质的量的变化曲线。
时段N2物质的量的变化曲线。
(3)某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图乙所示。请判断若不使用CO,NO直接分解为N2的反应为反应(填“放热”或“吸热”)。
(4)已知:①N2(g) + O2(g) 2NO(g)
2NO(g) 
②2C(s) + O2(g) 2CO(g)
2CO(g) 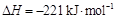
③2NO(g)+2CO(g)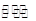 N2(g)+2CO2(g)
N2(g)+2CO2(g) 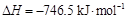
请写出表示C(s)的燃烧热的热化学方程式。
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用下图实验装置(两电极均为石墨电极)电解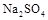 溶液来制取
溶液来制取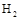 、
、 、
、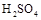 和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为,此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的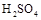 溶液从出口(填“A”、“B”、“C”或“D”)导出。
溶液从出口(填“A”、“B”、“C”或“D”)导出。
(3)利用制得的氢气为基本原料合成出甲醇,然后再用甲醇与氧气、氢氧化钠组成燃料电池,则该电池负极的电极反应式为。
下表是几种弱酸常温下的电离平衡常数:
 |
 |
 |
 |
 |
 |
 |
 |
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为。
(2)多元弱酸的二级电离程度远小于一级电离的原因是。
(3)同浓度的CH3COONa、NaHCO3、Na2CO3、Na2S溶液的pH由大到小的顺序为。
现有A、B、C三种烃,其球棍模型如下图: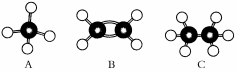
(1)分别取上述三种物质完全燃烧,生成水物质的量是二氧化碳物质的量的两倍的是_____(填序号)。
(2)与A和C是同系物,分子中碳原子数介于4到10的该系列物质,它们的核磁共振氢谱只有一种峰,它们的结构简式分别是____________、____________。
(3)A的同系物D在一定条件下形成的碳正离子: ,它是有机反应中重要的中间体,
,它是有机反应中重要的中间体,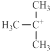 失去一个
失去一个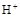 后将生成B的同系物F,F的结构简式为_________。
后将生成B的同系物F,F的结构简式为_________。
Ⅰ.铁是当代社会中用量最大的金属之一。已知:
①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g)ΔH=+172.5 kJ/mol
2CO(g)ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是。
Ⅱ.一定条件下,在一容积为4 L的密闭容器中通入0.4 molN2和1.2 molH2,发生反应:N2(g)+3H2(g) 2NH3(g)△H<0;
2NH3(g)△H<0;
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_____________。
(2)该条件下,反应的平衡常数表达式K =______,若降低温度,K值将_____(填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将_____移动(“向逆反应方向”、“向正反应方向”或“不”).
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为____________________。