“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Al(OH)3、Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
| A.①④ | B.①②④ | C.②④ | D.①②③④ |
下列说法正确的是
| A.两种原子形成的共价键一定是极性共价键 |
| B.元素金属性越强,对应单质的还原性越强;元素非金属性越强,对应单质的氧化性越强 |
| C.由金属元素和非金属元素组成的化合物一定是离子化合物 |
| D.按照元素周期表的排布规律,非金属元素最多有23种 |
同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2进行喷泉实验,经充分反应后,两瓶内溶液的物质的量浓度大小为
| A.①>② | B.①<② | C.①=② | D.不能确定 |
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是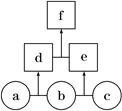
| A.常温下,单质a呈气态 | B.单质c具有强氧化性 |
| C.稳定性:d>e | D.f受热易分解为d和e |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。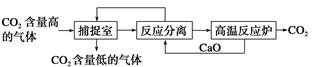
下列有关该方法的叙述中正确的是
①能耗小是该方法的一大优点
②整个过程中,有二种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
| A.①③ | B.②④ | C.③④ | D.①④ |
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是
| A.Zn和浓H2SO4 | B.C和浓HNO3 |
| C.Cu和浓HNO3 | D.Na2O2和NH4Cl浓溶液 |