实验室需要配制480mL 1mol·L-1的硫酸溶液,其实验步骤为
①计算所需浓硫酸的体积;
②将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中,轻轻的振荡;
③量取浓硫酸
④继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切
⑤用适量的蒸馏水稀释浓硫酸,冷却至室温;
⑥盖好瓶塞,摇匀;
根据上述信息回答问题:
(1)本实验操作步骤的正确顺序为___________
(2)若采用质量分数为98%(密度为1.84g·cm-3)的浓硫酸配制则需取用_____mL(保留小数点后一位);
(3)实验中用到的仪器除了量筒、烧杯、胶头滴管以外,还需要哪些仪器才能完成该实验__________;
(4)写出⑤中稀释硫酸的操作过程_________________________。
(5)如果实验遇到下列情况,对该硫酸物质的量浓度有何影响(填“偏高”、“偏低”或者“不变”)
①硫酸稀释后没有冷却至室温就转移至容量瓶并定容___________
②搅拌时不小心洒出一小滴溶液___________
③定容时俯视观察液面___________
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为(填名称)。
(2)写出“氧化”过程的离子方程式。
(3)“调pH”过程可以选用。(从以下选项选择,填序号)
A.H2SO4B.ZnOC.NaOH
“滤渣2”的主要成分是(填化学式,下同)。
(4)“试剂Y”是___________
(5)“操作1”是;在“操作1”时,必须采取的实验措施是。
(10分)对叔丁基苯酚( )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。
实验步骤如下: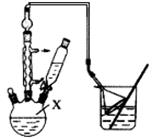
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向X中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为。
(2)步骤2中发生主要反应的化学方程式为 _________________________。
(3)图中倒扣漏斗的作用是。苯酚有腐蚀性,若其溶液沾到皮肤上可用洗涤。
(4)下列仪器在使用前必须检查是否漏液的是(填选项字母)。
| A.量筒 |
| B.容量瓶 |
| C.滴定管 |
| D.分液漏斗 |
E.长颈漏斗
(5)本实验中,对叔丁基苯酚的产率为。(请保留三位有效数字)
(14分)某化学兴趣小组为了探究AgNO3的性质,通过查阅资料和老师指导设计了如下实验:
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
| 实验操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,____________________,充分振荡 |
_____________________ _____________________ |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,____________________,充分振荡 |
_____________________ _____________________ |
不存在Fe2+ |
【实验结论】Fe的氧化产物为Fe3+。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。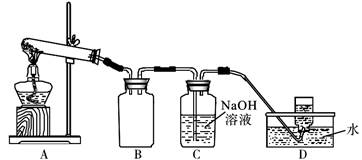
(2)装置B的作用是________________________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是___________________________________。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.__________________。
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
| 实验操作 |
现象和结论 |
【实验结论】若假设i成立,该小组得出AgNO3固体热分解反应的化学方程式为______________。
(15分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,常用于水的消毒杀菌和织物的漂白。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下: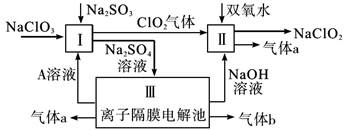
(1)反应I中的Na2SO3长期存放通常含有Na2SO4杂质,可用滴定法测定Na2SO3的纯度,向Na2SO3溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液应使用_________滴定管,滴定前,若该滴定管尖嘴处有气泡存在,赶除气泡的操作方法为____________________。
(2)Ⅱ中反应的离子方程式是_____________________________________________。
(3)A的化学式是________________,装置Ⅲ中b在极区产生______________________。
(4)已知ClO2对污水中CN-等有明显的去除效果,某工厂污水中含CN-amg/L,现用ClO2将CN-氧化生成两种无毒的气体,自身被还原为Cl-;该反应离子方程式为_____________;处理100m3这种污水,至少需要ClO2的质量为_______g(保留到小数点后一位)。
(5)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
HCN |
H2S |
| Ka |
1×10-2 |
6.3×10-4 |
4.9×10-10 |
K1=9.1×10-8 K2=1.1×10-12 |
常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为__________;体积相等、物质的量浓度相同的NaClO2、NaCN两溶液中所含阴阳离子总数的大小关系为________(填“前者大”、“相等”或“后者大”)。
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。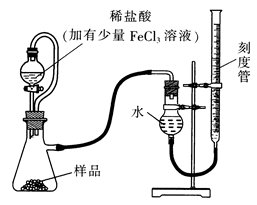
①实验前需进行的操作是.稀盐酸中加入少量FeCl3溶液的作用是。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;。
③实验终了时,待恢复至室温,先,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至。方案I中过氧化镁的质量分数为(用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量作指示剂;样品中过氧化镁的质量分数为(用含V的表达式表示)。