KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| 温度/℃ |
30 |
40 |
50 |
60 |
70 |
| 显色时间/s |
160 |
80 |
40 |
20 |
10 |
回答下列问题:
(1)该反应的离子方程式为______________________。
(2)该实验的目的是 ___________________________。
(3)实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要加入的显色试剂是__________________,实验现象为:________________。
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是________(选填字母)。
A.温度 B.试剂的浓度 C.试剂的用量(体积)
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是___________________
根据下列变化进行推断: 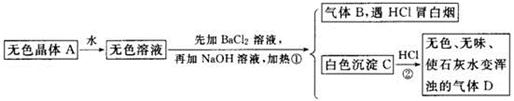
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
通常情况下,下列物质只能作氧化剂的是________(填选项编号,下同);既可作氧化剂,又可作还原剂的是________。
①浓H2 SO4 ②稀H2 SO4 ③H2S ④SO2 ⑤S ⑥HCl ⑦浓HNO3 ⑧稀HNO3
(1)在硝酸生产过程中所排放出来的废气中含有NO和NO2 ,它们污染环境,现用氨催化还原法将它们转化为无毒气体________(填化学式)直接排入空气中,写出有关反应方程式:________、________。
(2)假设NO和NO2 物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐,写出由烧碱溶液吸收这种酸酐的化学方程式________________________。
将还原性铁粉分别放入冷的浓H2SO4 、浓HNO3 中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H2SO4 中生成的气体呈无色,HNO 3 中生成的气体呈红棕色;剩余的固体经检验有磁性。试回答:
(1)Fe的氧化产物是________。(写化学式,下同)
(2)浓H2 SO4 的还原产物是________,浓HNO3 的还原产物是________。
某学生课外活动小组利用下图所示装置分别做如下实验: 
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。