请完成下列物质的分离提纯问题。
Ⅰ、现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
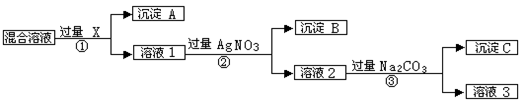
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______,沉淀B 。
(2)证明AgNO3加过量的实验方法是 。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
Ⅱ、某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:(填编号字母) 。
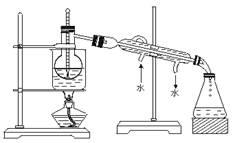
(2)设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。(3)最后碘的CCl4是通过 获得(填“漏斗上口”或“漏斗下口”)。从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有 处。
(4)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
实验室用下列装置所示的流程进行气体性质实验。图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水。根据图中装置和现象请回答:
(1)按上图组装好实验装置后,首先进行的操作是 。
(2)丙中发生反应的化学方程式为 。
(3)丁中应选用的干燥剂 ,戊中的反应开始后断开电源,铂丝继续保持红热,说明该反应 (填“吸热”或“放热”)。
(4)戊中发生的主要反应的化学方程式
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4﹣+5HSO3﹣+H+===2Mn2++5SO42﹣+3H2O填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
| A.酸式滴定管(50 mL) |
| B.碱式滴定管(50 mL) |
| C.量筒(10mL) |
| D.锥形瓶 |
E.铁架台
F.滴定管夹
G.烧杯
H.白纸
I.胶头滴管
J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因_______________。
(3)指示剂 _______ (填“需要”或“不需要”)选用,说明理由_______________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
为探究Na2CO3与盐酸的反应原理,设计了如右实验装置。
Ⅰ.步骤如下:
(1)在双通管中装12mL0.5mol/L的Na2CO3溶液,在针筒中装4mL3mol/L的盐酸。
(2)从底部向双通管中推入______mL的盐酸。几乎没有气泡产生,原因是:______________(用离子方程式解释)。
(3)将盐酸全部注入,产生大量气泡。
Ⅱ.此装置相对于往Na2CO3溶液中滴加盐酸,优点在于:_____________________。
Ⅲ.利用此装置往含往Na2CO3和另一种含钠的化合物A的混合液中注入稀盐酸,注入盐酸的体积与产生气体的体积关系如下图,则A的化学式为___________,该混合液中Na2CO3和A的物质的量之比为__________。
如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。填写下列空白:
(1)仪器a的名称为_________,实验时由a向烧瓶中加硫酸至_______(填“b”或“c”)
(2)为了能较长时间看到Fe(OH)2白色沉淀,关于活塞d,正确的操作为_______(填编号)
①实验开始时应先将关闭d,一段时间后再打开 ②实验开始时应先将打开d,一段时间后再关闭
(3)在B中观察到白色沉淀后,打开e,现象为_________反应的化学方程式为_______________。
某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
| 编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② |
向试管1中滴加几滴KSCN溶液,振荡 |
溶液出现血红色 |
| ③ |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为 。
(2)上述实验说明黑色粉末X中含有 。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
(1)操作Z的名称是 。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为 。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)= mol/L。