某些地区的水中可能含有下列盐类。当用新买来的铝壶烧水时,遇到水的地方会变成灰黑色,据此可以判断此地的水中含有( )
| A.钠盐 | B.钾盐 | C.铁盐 | D.钙盐 |
在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是
| A.V1=10V2 | B.V1>10V2 | C.V1<10V2 | D.V2>10V1 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是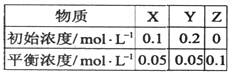

| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |
有4种混合 溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与 HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是
溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与 HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3,下列各项排序正确的是
| A.pH:②>③>④>① | B.c(CH3COO一):②>④>③>① |
| C.溶液中c(H+):①>③>②>④ | D.c(CH3COOH):①>④>③>② |
在体积可变的密闭容器中,反应mA(g)+nB(s)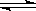 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
| A.(m+n)必定小于p | B.(m+n)必定大于p |
| C.m必定小于p | D.n必定大于p |
恒温恒压下,在容积可变的器皿中,反应2NO2(g)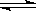 N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A不变 B增大 C减小 D无法判断