某种食用精制盐包装袋上有如下说明:
| 产品标准 |
GB5461 |
| 产品等级 |
一级 |
| 配 料 |
食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) |
20~50mg/kg |
| 分装时期 |
|
| 分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处) KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作为:
A.将碘的四氯化碳溶液置于分液漏斗中;
B.加入适量Na2SO3稀溶液;
C.分离出下层液体;
D.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 ,上述操作正确的顺序是: (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
A.准确称取wg食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
.十二烷基苯磺酸钠( )是常用普通洗衣粉的主要成分,其结构可用图形○—·来表示,·端为链烃基,○端为极性基。根据这一结构特点,试分析和回答下列问题:
)是常用普通洗衣粉的主要成分,其结构可用图形○—·来表示,·端为链烃基,○端为极性基。根据这一结构特点,试分析和回答下列问题:
(1)十二烷基苯磺酸钠分子在水溶液表面分布的结构形式图,应是下列各图中的______________图(填序号),理由是__________________________________________。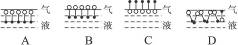
(2)进入水内部的十二烷基苯磺酸钠分子,可能会以下列结构形式图中的____________结构形式存在(填序号),理由是_____________________________________________________。
2mol油酸、1mol硬脂酸跟1 mol丙三醇完全反应,只生成一种甘油酯A,A可能的结构共有_____________种。硬化1 mol A需标准状况下H2_____________L,反应的化学方程式为________________________________________________________________________。
A在NaOH溶液中加热能发生_____________反应,反应的化学方程式为_______________。
参考下列(a)—(c)项回答问题:
(a)皂化值是使1 g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100 g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
| 花生油 |
亚麻仁油 |
牛油 |
黄油 |
硬化大豆油 |
大豆油 |
|
| 皂化值 |
190 |
180 |
195 |
226 |
193 |
193 |
| 碘值 |
90 |
182 |
38 |
38 |
5 |
126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是多少?
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_____________多,黄油比牛油的_____________小。硬化大豆油的碘值小的原因是_________________________________________________________________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为多少升(标准状况下)?
(4)结构简式为CnH2n+1COOC2H5的酯,若皂化值为430,求n为多少?
表面活性物质:
在工业上有较大的用途。当排入江河中,会产生严重的污染,导致水质恶化。试回答下列问题:
(1)该物质可以被生物降解,其降解的最终产物是什么?
(2)当它在水体中尚未被生物降解时,有人认为,它会导致水体缺氧。这句话是否符合事实,为什么?
某天然油脂A的分子式为C57H106O6。1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:___________________。
(2)写出C的结构简式:______________________;C的名称是_____________。
(3)写出含5个碳原子的C同系物的同分异构体的结构简式:______________________。
Ⅱ.RCH==CHR′与KMnO4碱性溶液共热后酸化,发生双键断裂生成羧酸:
RCH==CHR′ RCOOH+R′COOH,常利用该反应的产物反推含碳碳双键化合物的结构。
RCOOH+R′COOH,常利用该反应的产物反推含碳碳双键化合物的结构。
在催化剂存在下,1摩尔不饱和脂肪酸B和1摩尔氢气反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与KMnO4碱性溶液共热后酸化,得到如下四种产物:
HOOC—(CH2)10—COOH CH3—(CH2)7—COOH
HOOC—(CH2)7—COOH CH3—(CH2)4—COOH
(4)写出D和E的结构简式:____________________________________________________。
(5)写出B的结构简式:______________________________________________________。
(6)写出天然油脂A的一种可能结构简式:______________________________________。