(一)(1)钠及其化合物是中学化学常用物质,核潜艇或宇宙飞船常用过氧化钠做供氧剂,其原理是_______________________________、_______________________________(用化学方程式表示),若上述变化过程中消耗过氧化钠的质量为23.4g,则变化过程中转移电子数为_____________个。
(2)下列关于Na2O2的叙述正确的是__________
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,该物质可能是C6H12O6
D.Na2O2的漂白原理与SO2的漂白原理相同
E.Na2O2与水反应是水作还原剂的氧化还原反应
F.Na2O2与NaHCO3固体按物质的量之比1:1混合加热充分反应后,所得固体中Na2CO3和NaOH的物质的量之比亦为1:1
(二)切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如右图:

① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是_________________________________。
②1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 _________________________________。
(2)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(3) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因___________________________________。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  Ni + 2NaCl。其负极反应式是____________
Ni + 2NaCl。其负极反应式是____________
下图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题: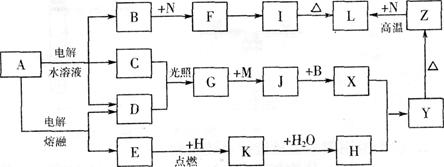
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用隔开。(填设备名称)
(2) 写出A的水溶液电解的离子方程式。
(3) 写出K与CO2反应的化学方程式。
(4) Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,写出该反应的离子方程式。
(5) 一定量的Z与N的混合物分为两等分,一份直接与足量氢氧化钠溶液产生气体为amol,另一份高温下充分反应(不考虑固体与氧气的反应)后的固体混合物与足量盐酸产生气体为bmol,现有a:b=9:7,则混合物中Z与N的物质的量之比为。
等质量的铜、锌、铁的金属混合物 加入FeCl3和盐酸的混合液中,充分反应(不考虑水电离出的离子)。
加入FeCl3和盐酸的混合液中,充分反应(不考虑水电离出的离子)。
(1)若无固体剩余,则溶液中的阳离子一定有,可能有;
(2)若剩余固体为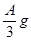 ,则溶液中的阳离子一定有,一定没有;
,则溶液中的阳离子一定有,一定没有;
(3)若剩余固体为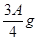 ,则溶液中的阳离子一定有_________,一定没有___________。
,则溶液中的阳离子一定有_________,一定没有___________。
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: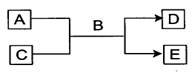
(1)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则该反应的化学方程式为:______,检验D中阴离子所用试剂为:。
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行。写出A与强碱溶液反应的离子方程式:
(3)若A、C均为化合物,C为引起温室效应的主要气体且过量,E为白色胶状沉淀,写出E可能的物质的化学式:或。写出其中一个生成E的离子方程式:。
有机物A可以通过不同的反应得到下列物质:
(1)A的结构简式是 _________
(2)写出由A制取B的化学方程式: ________________________
(3)写出A制取E物质的有机反应类型: _______________;A与 ____________(填写化学式)反应生成D。
(4)有机物C中共面的碳原子最多是_____个。
(5)芳香族化合物F是A的同分异构体,1molF可以和3mol NaOH发生中和反应;F苯环上的一氯代物只有一种。写出F三种可能的结构简式
__________________ __________________ ________________。
I、金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式、;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③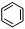
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiOFeO
(填“<”或“>”);
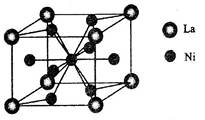
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;
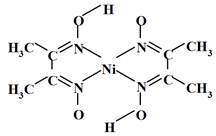
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如右下图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。