实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:

附表 相关物质的沸点(101 kPa)
| 物质 |
沸点/℃ |
物质 |
沸点/℃ |
| 溴 |
58.8 |
1,2二氯乙烷 |
83.5 |
| 苯甲醛 |
179 |
间溴苯甲醛 |
229 |
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2二氯乙烷和苯甲醛充分混合后,升温至60 ℃,缓慢滴加经浓H2SO4干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为____________。
(3)步骤2中用10% NaHCO3溶液洗涤有机相,是为了除去溶于有机相的____________(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是___________________。
(5)步骤4中采用减压蒸馏(在蒸馏装置上连接真空泵,使系统内压降低,从而使液体化合物在较低温度下沸腾而被蒸出)技术,是为了防止____________。
工业上用重铬酸钠(
)结晶后的母液(含少量杂质
)生产重铬酸钾(
),工艺流程及相关物质溶解度曲线如图: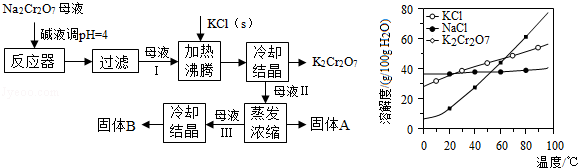
(1)由
生产
的化学方程式为,通过冷却结晶析出大量
的原因是.
(2)向
母液中加碱液调
的目的是 .
(3)固体
主要为(填化学式),固体
主要为(填化学式).
(4)用热水洗涤固体
,回收的洗涤液转移到母液(填"Ⅰ""Ⅱ"或"Ⅲ")中,既能提高产率又可使能耗最低.
工业上常利用含硫废水生产
,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶
中发生反应如下:
(I)
(II)
(III)
(1)仪器组装完成后,关闭两端活塞,向装置
中的长颈漏斗内注入液体至形成一段液注,若,则整个装置气密性良好。装置
的作用是。装置
中为溶液。
(2)为提高产品纯度,应使烧瓶
中
和
恰好完全反应,则烧瓶
中
和
物质的量之比为。
(3)装置B的作用之一是观察
的生成速率,其中的液体最好选择。
a.蒸馏水 b.饱和
溶液
c.饱和
溶液 d.饱和
溶液
实验中,为使
缓慢进入烧瓶
,采用的操作是。已知反应(III)相对较慢,则烧瓶
中反应达到终点的现象是。反应后期可用酒精灯适当加热烧瓶
,实验室用酒精灯加热时必须使用石棉网的仪器含有。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶
中的溶液经蒸发浓缩即可析出
,其中可能含有
、
等杂质。利用所给试剂设计实验,检测产品中是否存在
,简要说明实验操作,现象和结论:。
已知
遇酸易分解:
↓
↑
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、
溶液、
溶液
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线: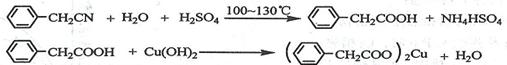
制备苯乙酸的装置示意图如下(加热和夹持装置等略):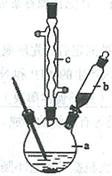
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是;仪器c的名称是,其作用是。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是,最终得到44 g纯品,则苯乙酸的产率是。
(4)用
和
溶液制备适量
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是。
磷酸铁(
,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是。
(2)向滤液中加入一定量
氧化
。为确定加入
的量,需先用
标准溶液滴定滤液中的
,离子方程式如下:
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、和。
②若滴定x
滤液中的
,消耗a
标准溶液b
,则滤液中
=
③为使滤液中的
完全被
氧化,下列实验条件控制正确的是(填序号)。
| A. | 加入适当过量的 溶液 | B. | 缓慢滴加 溶液并搅拌 |
| C. | 加热,使反应在较高温度下进行 | D. | 用氨水调节 =7 |
(3)将一定量的 溶液(溶液显碱性)加入到含有 的溶液中,搅拌、过滤、洗涤、干燥得到 。若反应得到的 固体呈棕黄色,则磷酸铁中混有的杂质可能为。
实验室从含碘废液(除
外,含有
、
、
等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的
溶液,将废液中的
还原为
,其离子方程式为;该操作将
还原为
的目的是。
(2)操作X的名称为。
(3)氧化时,在三颈烧瓶中将含
的水溶液用盐酸调至pH约为2,缓慢通入
,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为。
(4)已知: 某含碘废水(pH约为8)中一定存在 ,可能存在 、 中的一种或两种。请补充完整检验含碘废水中是否含有 、 的实验方案:取适量含碘废水用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;
。
实验中可供选择的试剂:稀盐酸、淀粉溶液、
溶液、
溶液