(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的
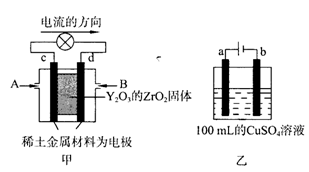
①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。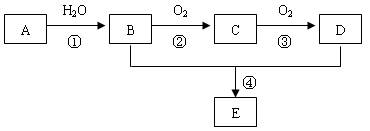
请回答下列问题:
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)物质B可以被直接氧化为D,需要加入的试剂是。
(4)写出下列反应的化学方程式:
①;反应类型:。
④。反应类型:。
某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,写出该烃同分异构体的结构简式:
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水。观察现象,完成下表。
| 乙醇与钠反应的现象 |
气体燃烧的现象 |
检验产物 |
| 气体燃烧时火焰呈, 小烧杯内壁, 澄清石灰水。 |
反应中只生成了 |
写出乙醇与钠反应的化学方程式
已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系: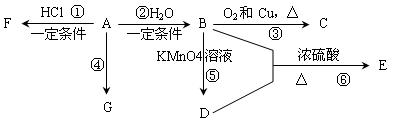
请回答下列问题:
(1)A的官能团的名称是________________;C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→的反应方程式为:___________________________________,该反应类型是_______________;
如何除去E中所混有少量的D杂质,简述操作过程:________________________________________
______________________________________________________________________________________;
(3)G是一种高分子化合物,其名称是_____________,链节是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:________________________________,该反应的原子利用率为__________,决定F能用于冷冻麻醉应急处理的性质是________________________________
__________________________________________。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,B和C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数比K、M两个电子层上的电子数之和少1。A的氢化物遇到D的氢化物会产生大量白烟F。请回答下列问题:
(1)A在周期表中和位置__________________;D的最高价氧化物的水化物化学式是_____________。
(2)写出E与水反应的化学方程式:__________________________________________。
(3)E属于__________(填“离子”或“共价”)化合物。它的电子式为:________________。
(4)A的氢化物遇到D的单质也会发生反应产生大量白烟,同时生成A的单质,请写出该反应的化学方程式:____________________________________。