工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示: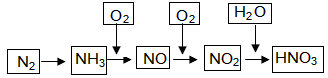
请回答:
(1)NO2与H2O反应中的还原剂是______________。
(2)NH3与O2制取NO的化学反应方程式_________________。
(3)下列说法不正确的是(选填序号字母)_________________。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标况下,该浓硝酸与足量铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为___________。
(5)已知:
①H2(g)+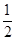 O2(g)=H2O(g)△H1=-241.8kJ/mol,
O2(g)=H2O(g)△H1=-241.8kJ/mol,
②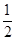 N2(g)+O2(g)= NO2(g) △H2=+33.9kJ/mol,
N2(g)+O2(g)= NO2(g) △H2=+33.9kJ/mol,
③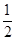 N2(g)+
N2(g)+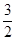 H2(g)=NH3(g)△H2=-46.0kJ/mol
H2(g)=NH3(g)△H2=-46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H=___________kJ/mol。
如图所示3套实验装置,分别回答下列问题。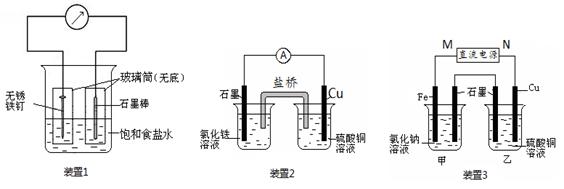
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液有蓝色沉淀,表明铁被(填“ 氧化”或“还原”); 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为。
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程式为。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为极(填“正”或“负”),甲烧杯中铁电极的电极反应为。
② 乙烧杯中电解反应的化学方程式为。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为mL 。
常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
一元酸 |
NaOH |
混合溶液的pH |
| 甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
| 乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
| 丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
| 丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为。
(2)乙组实验中HY为强酸,则HY溶液的pH=。
(3)丙组实验发生反应的离子方程式为,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。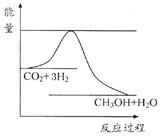
(1)关于该反应的下列说法中,正确的是。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)该反应平衡常数K的表达式为。
(3)温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1。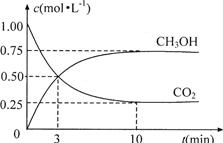
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
E.充入He(g),使体系总压强增大
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是,除此之外,装置中的一个明显错误是。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视。
(2)在铁架台上垫一张白纸,其目的是。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果。
人们习惯上按不同的溶解性,把维生素分为____________性维生素和____________性维生素两大类,维生素C溶液显酸性,又称为____________。