硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2 → S4O62- + 2I- 。
(Ⅰ)制备Na2S2O3·5H2O

①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热。圆底烧瓶中发生反应的化学方程式 。
②C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。C中碳酸钠的作用是 。D中可能发生的离子反应方程式为: 。“停止C中的反应”的操作是 。
③过滤C中的混合液。将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
④装置B中盛放的试剂是(填化学式) 溶液,其作用是 。
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
| 编号 |
1 |
2 |
3 |
| 溶液的体积/mL |
10.00 |
10.00 |
10.00 |
| 消耗I2标准溶液的体积/mL |
19.95 |
17.10 |
20.05 |
滴定时,达到滴定终点的现象是 。
Na2S2O3·5H2O在产品中的质量分数是 (用百分数表示,且保留1位小数)。
某化学研究性学习小组探讨Fe3+和SO32—之间发生怎样的反应,请你一起参与并协助他们完成实验。
(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3; ……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:;
②实验③中溶液变成血红色的离子方程式为。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有。
实验室为了制得少量漂白粉,常用浓盐酸与二氧化锰先制取氯气,再用氯气与消石灰反应。已知氯气与氢氧化钙制漂白粉是放热反应[2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。
Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。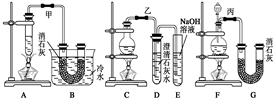
(1)请对三套装置的优缺点进行评价,并将选项序号填于下表内。a.容易引起环境污染
b.可防止环境污染 c.可防止副反应发生 d.易发生副反应 e.易控制反应速率 f.不易控制反应速率
| 优点 |
缺点 |
|
| 甲装置 |
||
| 乙装置 |
||
| 丙装置 |
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G)组装一套你认为更完整的实验装置,则连接顺序为(按气流从左到右方向)。
(3)在你所设计的装置及以上甲、乙、丙装置中,是否还缺少其他必要的装置,说明原因:。
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为。
(2)在上述实验方案中有一明显欠缺,该欠缺是。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是;最终产生氢气的体积关系应是。
(4)实验中产生的氢气体积比理论值高,可能原因是。
(5)通过比较起始反应的速率可以得出的结论是。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)="0.1mol/L" B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
(1)写出以下两种仪器的名称: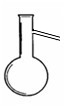 A:
A: B:
B:
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为_________g.
(3)指出下面实验中存在的错误:
现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、 FeO、SiO2)为原料制备高纯氧化铁(软磁α- Fe2O3)的生产流程示意图: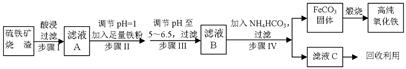
①步骤I中过滤所得滤渣的主要成分是。
②步骤II中加入铁粉的目的是。
③步骤Ⅲ中可选用试剂调节溶液的pH(填标号)。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式。
⑤从滤液C中回收的主要物质的一种用途是。