某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

请回答下列问题:(1)该同学欲确定反应一段时间后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管中固体物质的成分是(只有一个选项符合题意) _________;若溶液未变红色则说明硬质试管中固体物质的成分是(只有一个选项符合题意)________。
A.一定有Fe3O4,可能有Fe B.只有Fe(OH)3
C.一定有Fe3O4和Fe D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(2)该同学按上述实验方案进行了实验,结果溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象。

请写出与上述现象相关的反应的化学方程式_________________、________________。
(3)一段时间后,该同学发现(2)中未变红的溶液变成红色,说明Fe2+ 具有______性。由此可知,实验室中含Fe2+的盐溶液需现用现配制的原因是_________,并且配制[含Fe2+的盐溶液时应加入少量______。
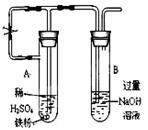
(4)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用如图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是____________。反应开始时,打开止水夹的目的是__________________;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的沉淀。
(5)同学们在学习了铁的性质后知道Fe3+和CO32-不能大量共存的原理,那么Fe2+和CO32-是否发生相似的反应呢?某学习小组查阅“部分酸碱盐溶解性表”,在“部分酸碱盐溶解性表”中存在“碳酸亚铁”。
他们设计实验探究碳酸亚铁的性质。实验如下将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体。放置一段时间未见沉淀有明显变化。
①试写出反应离子方程式: 。
探究碳酸亚铁的热稳定性(加热仪器省略)
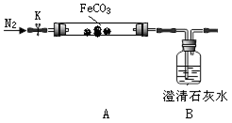
连接仪器、装药品。打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊。待固体分解完后,继续通入氮气至玻璃管冷却。
②先通入氮气的目的是 。B瓶现象能说明 。
③停止加热之前,是否拆开A、B之间橡胶管?答: ;理由是 。
④若不通入氮气直接加热分解则分解的固体产物可能是 ; ; 理由是
(12分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是_______________________________
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”),简述理由___
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”“无影响”)。
氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是。
(2)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
①实验现象为:黑色CuO变为红色;白色无 水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式。
水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式。
②碱石灰的作用是。
(3)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。
已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差
(Cu2O+2H+=" Cu" + Cu2+ +2H2O)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将(填“偏大”、“偏小”或“无影响”);
(2)测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于(已知:Ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是。
(4)有同学提出可采用如下装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。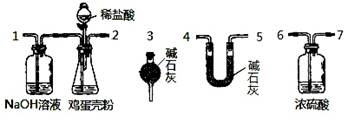
①采用该方法进行实验,各装置从左到右的连接顺序依次:
1—2—__ ________________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:________(填“准确”、“不一定准确”或“无法判断”)。
原因是_____________________
。
(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列实验操作的描述中,正确的是(填字母序号)。
| A.从试剂瓶中取出的药品,若有剩余再放回原试剂瓶 |
| B.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| C.蒸馏操作时冷凝管进出水的方向是上口进,下口出 |
| D.NaOH溶液不能保存在带有玻璃塞的试剂瓶中 |
E.将稀盐酸滴到pH试纸上,并与标准比色卡比较,测定稀盐酸的pH
F.分液操作所示,分液漏斗中下层液体从下口放出,上层液体上口倒出
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“=”填写下列空白:
①用托盘天平称取8.4g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取氯化钠的质量8.4g。
②用容量瓶配制500mL0.1mol·L-1NaOH溶液,定容时仰视刻度线,所得NaOH溶液的物质的量浓度0.1mol·L-1。
③中和滴定实验时锥形瓶用蒸馏水洗净后未用标准液润洗,则测得锥形瓶中待测液的浓度实际浓度。
(12分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)写出实验室制取NH3的化学方程式 。
(2)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接,接,接h;
(3)用右图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用(选填字母编号);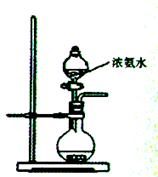
| A.碱石灰 | B.生石灰 | C.无水氯化钙 | D.无水硫酸铜 E.烧碱 |
(4)向浓CaCl2溶液中通人NH3和C02气体制纳米级碳酸钙时,应先通人的气体是 ,试写出制纳米级碳酸钙的化学方程式 ;
(5)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
。