下列离子方程式正确
| A.硝酸银溶液与铜:Cu+Ag+=Cu2++Ag |
| B.氧化铜与盐酸反应:O2-+2H+=H2O |
| C.碳酸钡与盐酸:CO32-+2H+=H2O+CO2↑ |
| D.Cu(OH)2加入H2SO4:2H++Cu(OH)2 = Cu2+ +2H2O |
下列物质的化学用语正确的是
①NH4H的电子式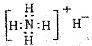 ②硝基苯的结构简式:
②硝基苯的结构简式: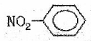
③葡萄糖的实验式:CH2O④甲烷分子的比例模型: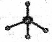
⑤Fe2+的离子结构: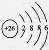 ⑥原子核内有10个中子的氧原子:
⑥原子核内有10个中子的氧原子: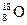
| A.②③⑥ | B.①③⑤⑥ | C.③⑥ | D.①②③④⑤⑥ |
联合国气候变化大会于2009年12月7日~18日在丹麦首都哥本哈根召开,焦点议题之一是发展“低碳经济”,减少温室气体排放。你认为下列做法中不能有效减少空气中CO2含量的是
| A.开发利用太阳能、风能、生物能、海洋能等清洁能源 |
| B.使用节能产品,推广节能环保汽车 |
| C.植树造林,增加森林植被面积 |
| D.用脱硫处理的煤代替原煤作燃料 |
4分)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
⑴生活中的玻璃、陶瓷、水泥属于上述材料中的,其生产原料不需要使用石灰石的是。塑料制品给人类生活带来很多方便,但塑料制品造成的“白色污染”已成为社会的一大公害,请你提出一项防治“白色污染”的有效措施:。
⑵金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的,发生电化学腐蚀。
.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是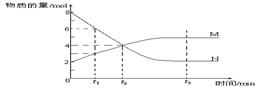
A.反应的化学方程式为:2M N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率等于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述不正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物