在体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
| A.N2为0.2 mol·L-1,H2为0.6 mol·L-1 |
| B.N2为0.15 mol·L-1 |
| C.N2、H2均为0.18 mol·L-1 |
| D.NH3为0.4 mol·L-1 |
已知Cu+在酸性条件下能发生下列反应:Cu+ Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中铜元素全部被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )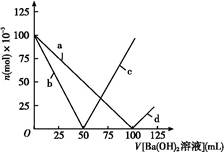
| A.曲线a表示Ba2+的物质的量的变化 |
| B.曲线c表示OH-的物质的量的变化 |
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O BaSO4↓+H2O |
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O H2O |
下列离子方程式正确的是( )
A.向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3— Fe3++NO↑+2H2O Fe3++NO↑+2H2O |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- CaSO3↓+2HClO CaSO3↓+2HClO |
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O HClO+HCO3— HClO+HCO3— |
D.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42— BaSO4↓+2H2O BaSO4↓+2H2O |
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是( )
| A.Fe3+ | B.Fe2+ | C.Al3+ | D.NH4+ |
下列各组离子在指定溶液中一定能大量共存的是( )
| A.能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3—、Cl- |
| B.由水电离出的c(H+)=1×10-11 mol·L-1的溶液:Na+、Mg2+、Cl-、NO3— |
| C.0.2 mol·L-1的NaNO3溶液:H+、Fe2+、SO42—、Cl- |
| D.与Fe反应生成H2的溶液:NH4+、K+、SO42—、CO32— |