利用废铁丝和工业硫酸铜废液(含硫酸亚铁)制备硫酸铜晶体。生产过程如下:
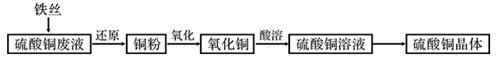
试回答下列问题:
(1)利用硫酸铜的 性质,常在游泳池中加入硫酸铜晶体杀菌消毒。
(2)废铁丝中含有铁锈((Fe2O3・xH2O))在投入硫酸铜废液前需用稀H2SO4进行处理,其主要发生反应的离子方程式_____________________。
(3)铜粉氧化过程中,颜色由粉红变为黑色,再由黑色变绿色。取绿色粉末加入稀硫酸溶液,溶液变蓝,产生无色无味气体,经检验为二氧化碳。推测该绿色粉末为 。(填化学式)
(4)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(5)硫酸铜溶液常作电解液,试写出用石墨电极电解硫酸铜溶液阳极反应式: 。
(6)在0.10mol・L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol・L-1(K sp[Cu(OH)2]=2.2×10-20)。
450K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
△H=-96.56kJ/mol,△S=-190 J•mol-1•K-1。
甲容器在反应过程中保持压强不变,乙容器保
持体积不变,丙容器维持绝热,三容器各自建
立化学平衡。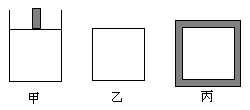
(1)平衡常数:K (甲)K (乙)_K(丙) (填“>”、“<”或“=”)。
(2)达到平衡时SO2的转化率:α(甲) _α(乙) _ α(丙)(填“>”、“<”或“=”)。
(3)达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体, 甲容器的化学平衡________移动,乙容器的化学平衡_________移动。(填“正向”、“逆向” 或“不”)
(4)通过计算确定5000C时正反应 ____(填“能” 或“不能”)自发进行。
(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。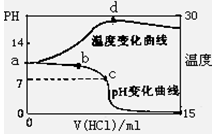
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点: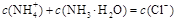
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
| 离子浓度的关系 |
溶质 |
溶液的pH |
物料守恒关系 |
|
| ① |
C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
pH>7 |
/ |
|
| ② |
NH4Cl |
/ |
||
| ③ |
C(Cl-)>C(H+)>C(NH4+)>C(OH-) |
pH<7 |
/ |
在一密闭体系中发生下列反应:N2(g)+3H2(g) 2NH3(g);△H<0 。
2NH3(g);△H<0 。
回答下列问题:
(1)在一定温度下,向一容积为2L的密闭容器中通入0.3molN2和0.9molH2,2min达到平衡时,C(N2)为0.1mol/L,则H2的转化率为____________________,用H2浓度变化表示的平均
反应速率为______ ,该温度下的平衡常数K= ____________。
(2)若要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡状态(1)相同,则起始时n(NH3)的取值范围为 ___________________。
(3)右图是某一时间段速率-时间曲线图。
若图中t1时刻将容器体积变为原来的1/2倍,当t2时刻再次达到平衡时N2的浓度为原平衡的1.9倍,则平衡 _____
(“正移”“逆移”“不移动”)。
①请在图中画出t1→t2时间段反应速率变化情况。
②t3、t5时刻体系中所改变的某一条件分 别是:__________________________、_______________;其中表示平衡混合物中NH3的含量最高的时间段是___________.
(6分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)终点的判断:溶液由_____________________________________________________。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用
盐酸溶液的体积为_________ml。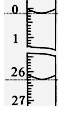
(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
平均耗用盐酸 体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.15 |
①V=__________ |
| 第二次 |
25.00 |
0.56 |
30.30 |
|
| 第三次 |
25.00 |
0.20 |
26.45 |
②依据上表数据列式计算该NaOH溶液的物质的量浓度(计算结果取4位有效数)。
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);ΔH1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH
(l);ΔH2=-Q2 kJ/mol,H2O(g)=H2O(l);ΔH3=-Q3 kJ/mol。若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为 ________________kJ。
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内
熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题: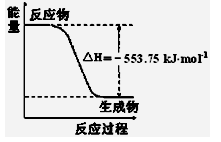
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式。
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:__________________________________________。
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4 g,在该含氧酸盐中金属的化合价为 ____,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是 __g(结果精确至0.01 g)。
④二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 ____。